
| A. | 热稳定性:HCl>H2S | B. | 原子半径:N>O | ||
| C. | 结合质子能力:S2->Cl- | D. | 酸性:H2SO3>H2SO4 |
分析 A.元素的非金属性越强,其氢化物的稳定性越强;
B.同一周期元素,原子半径随着原子序数增大而减小;
C.元素的非金属性越强,其简单阴离子结合氢离子能力越弱;
D.同一种非金属元素的含氧酸,中心元素化合价越高,其酸性越强.
解答 解:A.元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>S,所以氢化物的稳定性HCl>H2S,故A正确;
B.同一周期元素,原子半径随着原子序数增大而减小,所以原子半径N>O,故B正确;
C.元素的非金属性越强,其简单阴离子结合氢离子能力越弱,非金属性Cl>S,结合质子能力:S2->Cl-,故C正确;
D.同一种非金属元素的含氧酸,中心元素化合价越高,其酸性越强,所以酸性:H2SO3<H2SO4,故D错误;
故选D.
点评 本题考查同一周期元素性质递变规律,为高频考点,明确元素非金属性与其氢化物的稳定性、最高价氧化物的水化物酸性、其简单阴离子结合质子能力之间的关系是解本题关键,易错选项是D.


科目:高中化学 来源: 题型:选择题
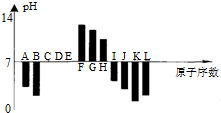
| A. | 元素B对应的氢化物比J对应的氢化物熔沸点更高,原因是B的氢化物中的键能比J中的大. | |
| B. | 根据图形分析可知,K,L两种元素最高价氧化物对应的水化物的酸性,前者较强. | |
| C. | 晶体IC2熔化时克服的化学键和晶体KC2与水反应时克服的化学键,类型相同. | |
| D. | 元素K、H、G分别形成的简单离子的半径逐渐减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该混盐水溶液呈碱性 | |
| B. | 该混盐与H2SO4反应有气体生成 | |
| C. | 该混盐溶液加入BaCl2可以生成白色沉淀 | |
| D. | 该混盐在酸性条件下可生成S,每产生32g S转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
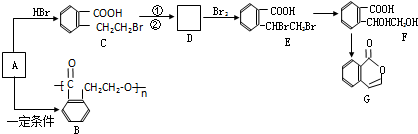
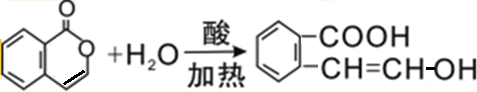
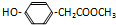 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
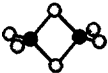 硼的最简单氢化物--乙硼烷球棍模型如图,由它制取硼氢化锂的反应为:2LiH+B2H6=2LiBH4
硼的最简单氢化物--乙硼烷球棍模型如图,由它制取硼氢化锂的反应为:2LiH+B2H6=2LiBH4查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在室温下,向0.02mol/L的Na2CrO4溶液中滴加0.01mol/L的稀硫酸,溶液由黄色转变成橙红色的Na2Cr2O7,溶液中水Kw增大,在此转化过程中,各物质的量浓度变化如图所示.下列说法正确的是( )
在室温下,向0.02mol/L的Na2CrO4溶液中滴加0.01mol/L的稀硫酸,溶液由黄色转变成橙红色的Na2Cr2O7,溶液中水Kw增大,在此转化过程中,各物质的量浓度变化如图所示.下列说法正确的是( )| A. | 向以上反应加入一定量的Na2CO3溶液,对平衡几乎没有影响 | |
| B. | 升高温度,混合溶液的颜色逐渐加深 | |
| C. | 该反应的离子方程式为:2CrO42-+2H+═Cr2O72-+H2O | |
| D. | 该反应的化学平衡常数为5.0x102 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 浓H2SO4和NaCl晶体 | B. | 甲酸和浓H2SO4(制CO) | ||
| C. | MnO2和浓硫酸 | D. | 浓H3PO4和NaBr晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
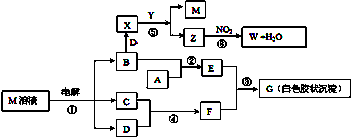
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com