
分析 元素A的阳离子mAa+与元素B的阴离子nBb-具有相同的电子层结构,即两种离子核外电子数相同,且A元素位于B元素下一周期,
①离子的原子序数等于其核内质子数;
②原子电子层数越多,其原子半径越大;
③电子层结构相同的离子,离子半径随着原子序数增大而减小;
④金属元素最外层电子数小于4,非金属元素最外层电子数等于或大于4;
⑤阳离子核外电子数=质子数-电荷数,阴离子核外电子数=质子数+电荷数;
⑥a+b不等于8而小于8.
解答 解:元素A的阳离子mAa+与元素B的阴离子nBb-具有相同的电子层结构,即两种离子核外电子数相同,且A元素位于B元素下一周期,
①离子的原子序数等于其核内质子数,所以A原子序数是m、B原子序数是n,A在B元素下一周期,所以原子序数A>B,故正确;
②原子电子层数越多,其原子半径越大,A原子电子层数大于B,所以原子半径A>B,故正确;
③电子层结构相同的离子,离子半径随着原子序数增大而减小,原子序数A>B,所以离子半径A<B,故错误;
④金属元素最外层电子数小于4,非金属元素最外层电子数等于或大于4,所以原子最外层电子数B>A,故正确;
⑤阳离子核外电子数=质子数-电荷数,阴离子核外电子数=质子数+电荷数,两种离子核外电子数相等,所以m-a=n+b,故错误;
⑥a+b不等于8而是小于8,a、b都可能是1、2或3,所以a与b的和一定不等于8,故错误;
故选①②④.
点评 本题考查原子结构和元素周期律,为高频考点,明确原子结构、元素周期律是解本题关键,知道阴阳离子核外电子数计算方法,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
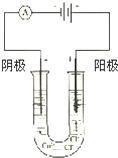 按如图所示装置连接好仪器在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象.
按如图所示装置连接好仪器在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
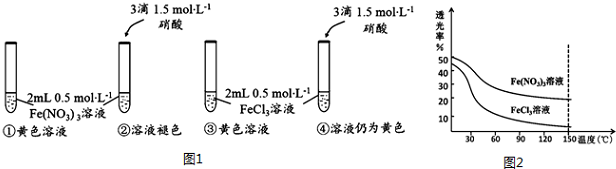
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
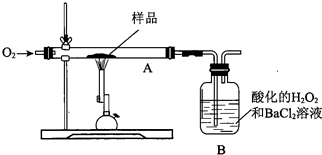
| A. | 测B中沉淀质量 | B. | 测锻烧后A中固体的质量 | ||
| C. | 测B吸收瓶反应前的质量 | D. | 将W蒸干、灼烧,测所得固体质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
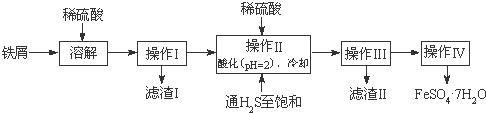
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做钠盐溶液的焰色反应时,用铂丝蘸取溶液放在酒精灯火焰上灼烧 | |
| B. | 分液时,下层液体先从分液漏斗下口放出,换一个接收容器,再将上层液体从分液漏斗下口放出 | |
| C. | 浓NaOH溶液沾到皮肤上,先用稀硫酸冲洗,再用水冲洗 | |
| D. | 用氨水清洗做过银镜反应的试管内壁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com