
| A、称量12.8g CuSO4固体,在100mL烧杯中加入80mL蒸馏水充分溶解 |
| B、称量20g CuSO4?5H2O固体,用80mL容量瓶配制成溶液 |
| C、用容量瓶配制溶液过程中,玻璃棒起搅拌加速溶解和引流液体的作用 |
| D、当用胶头滴管定容时,若视线偏低,则所配制的溶液浓度偏低 |


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、SiO32-、OH-、Na+ |
| B、Na+、H+、CO32-、SO42- |
| C、K+、H+、SiO32-、Cl- |
| D、OH-、Na+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Ca2+、Na+、HCO3- |
| B、Na+、Mg2+、Al3+、Cl- |
| C、Cu2+、Mg2+、Cl-、OH- |
| D、Ba2+、Cl-、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
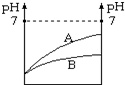 常温下,等体积pH值等于2的两种酸溶液HA和HB,分别加水稀释1000倍,其pH值与所加水的体积变化如图所示;则下列结论正确的是( )
常温下,等体积pH值等于2的两种酸溶液HA和HB,分别加水稀释1000倍,其pH值与所加水的体积变化如图所示;则下列结论正确的是( )| A、HB是弱酸,HA是强酸 |
| B、酸HA是比酸HB更强的酸 |
| C、稀释前酸HA的物质的量浓度大 |
| D、酸HB是比酸HA更强的酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2O4 中,N的化合价为+4 |
| B、此反应中,偏二甲肼做还原剂 |
| C、此反应中,N2O4失去电子 |
| D、此反应中,R的分子式为C2H8N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com