
| A、在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
| B、能使酚酞变红色的溶液中:Na+、K+、S2-、SO32- |
| C、室温下由水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液中:Ba2+、NO3-、K+、F- |
| D、含大量Fe3+的溶液中:NH4+、Na+、C1-、HS- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
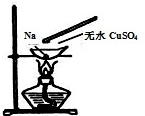 如图,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成.据此判断下列说法中不正确的是( )
如图,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成.据此判断下列说法中不正确的是( )| A、上述反应是置换反应 |
| B、上述反应说明钠比铜活泼 |
| C、上述反应证明钠可以从CuSO4溶液中置换出铜 |
| D、加热且无水条件下,Na可以与CuSO4反应并生成Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大FeO(s)表面积 |
| B、增大体系压强 |
| C、升高体系温度 |
| D、使用适合的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3能氧化氮氧化物,可用于汽车尾气净化 |
| B、Mg、Fe等金属在一定条件下与水反应都生成H2和对应的氢氧化物 |
| C、Fe在O2中的燃烧产物可用于制红色涂料 |
| D、Mg (OH)2分解吸热且生成高熔点固体,可用作阻燃剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 |
| B、在H2O2分解过程中,溶液的H+浓度逐渐下降 |
| C、在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 |
| D、H2O2生产过程中往往需要加入少量Fe2+以提高产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、SO42-、K+、Cl- |
| B、Na+、NH4+、NO3-、MnO4- |
| C、K+、Cu2+、Cl-、Br- |
| D、Ba2+、Na+、OH-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
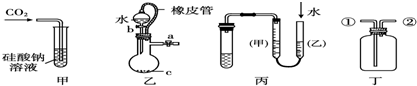
| A、甲装置:可用来证明碳酸的酸性比硅酸强 |
| B、乙装置:c为二氧化硅可制硅酸 |
| C、丙装置:可进行氢氟酸与二氧化硅的反应并测定气体体积 |
| D、丁装置:从②口进气可用于收集二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
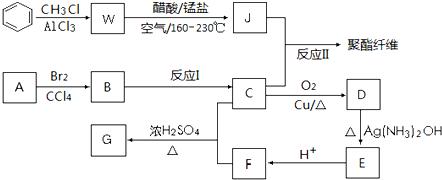
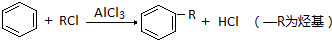

查看答案和解析>>
科目:高中化学 来源: 题型:
 电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com