
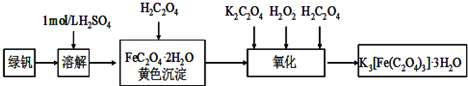
分析 制备K3[Fe(C2O4)3]•3H2O的流程:硫酸亚铁加入稀硫酸抑制Fe2+水解,硫酸亚铁与草酸反应生成草酸亚铁沉淀,用过氧化氢将草酸亚铁氧化为K3[Fe(C2O4)3],加入草酸溶液煮沸后,一定条件下结晶得到K3[Fe(C2O4)3]•3H2O晶体.
(1)依据亚铁盐易被氧化,需要加入铁粉防止氧化,2Fe3++Fe=3Fe2+;
(2)溶液中得到绿矾的实验操作是蒸发浓缩,冷却结晶,过滤洗涤,干燥步骤得到;
(3)依据溶液配制的步骤选择需要的仪器,配制溶液步骤为,称量、溶解、转移、洗涤、定容、摇匀;
(4)根据锌粉能与Fe3+反应,加入锌粉的目的是将Fe3+全部还原成Fe2+;
(5)步骤3中是高锰酸钾在酸溶液中氧化亚铁离子为铁离子,本身被还原为锰离子的反应,依据电荷守恒和原子守恒配平得到离子方程式;
(6)若在步骤2中滴入酸性高锰酸钾溶液不足,则会有部分草酸根未被氧化,在步骤3中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多;
(7)根据气体的密度为求出其摩尔质量,然后根据摩尔质量和质量守恒来判断成分;依据信息:固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3,结合电子得失守恒,可推测铁元素只能以亚铁和铁单质的形式存在;最后写出方程式.
解答 解:(1)Fe2+容易被空气中的氧气氧化,所以可用铁粉将Fe3+还原成Fe2+,2Fe3++Fe=3Fe2+,同时不引入杂质,
故答案为:铁;防止Fe2+被氧化;
(2)将混合液来制备绿矾时应先将溶液加热浓缩、然后冷却结晶,将析出的固体过滤、洗涤、干燥,即可得到绿矾,
故答选:bcae;
(3)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,故答案为:250ml容量瓶;洗涤;
(4)加入锌粉的目的是将Fe3+全部还原成Fe2+,
故答案为:将Fe3+全部还原成Fe2+;
(5)MnO4-能氧化Fe2+得到Fe3+和Mn2+,在步骤3中发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(6)若在步骤2中滴入酸性高锰酸钾溶液不足,则会有部分草酸根未被氧化,在步骤3中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高,
故答案为:偏高;
(7)气体密度为1.647g/L,其摩尔质量为1.647g/L×22.4L/mol=36.9g/mol,所以气体为CO和C02,两者的物质的量之比 $\frac{44-36.9}{36.9-28}$=$\frac{4}{5}$,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3,结合电子得失守恒,可推测铁元素只能以亚铁和铁单质的形式存在,故方程式为:2K3[Fe(C2O4)3]═3K2CO3+Fe+FeO+4CO+5CO2,
故答案为:2K3[Fe(C2O4)3]═3K2CO3+Fe+FeO+4CO+5CO2.
点评 本题主要考查溶液的配制、滴定和结晶等操作,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题.


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:选择题
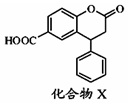
| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和Na2CO3溶液反应 | |
| C. | 在酸性条件下水解,水解产物只有一种 | |
| D. | 1mol化合物X最多能与7molH2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | H-H | C-O | C≡O (CO中的化学键) | H-O | C-H |
| E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 1 | 3 | 5 | 9 | 10 | 14 |
| X/mol | 1.00 | 0.90 | 0.75 | 0.65 | 0.55 | 0.55 | 0.55 |
| Y/mol | 1.00 | 0.80 | 0.50 | 0.30 | 0.10 | 0.10 | 0.10 |
| Z/mol | 0.00 | 0.20 | 0.50 | 0.70 | 0.90 | 0.90 | 0.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C1-、Br-、CrO42- | B. | CrO42-、Br-、C1- | C. | Br-、C1-、CrO42- | D. | Br-、CrO42-、C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.9 mol/L | B. | 1.8 mol/L | C. | 0.7mol/L | D. | 0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2a=3b | |
| B. | 7b=4a | |
| C. | 原混合气体中V(H2)=bL,V(O2)=(a-b)L | |
| D. | 原混合气体中V(H2)=2(a-b)L,V(O2)=(2b-a)L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com