
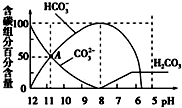
| A. | 0.1 mol/L Na2CO3溶液中c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 当加入20 mL盐酸时,混合溶液的pH约为8 | |
| C. | 常温下CO2饱和溶液的pH约为5.6 | |
| D. | 在A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
分析 A.根据溶液的电荷守恒判断;
B.c(HCO3-)=100%时,溶液的pH=8;
C.pH≈5.6时,溶液浓度不变,溶液达到饱和;
D.由图象可知,A点c(HCO3-)=c(CO32-),溶液呈碱性,则c(OH-)>c( H+).
解答 解:A.Na2CO3溶液中存在电荷守恒,为c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故A正确;
B.c(HCO3-)=100%时,溶液的pH=8,说明0.05mol/L NaHCO3溶液的pH=8,当加入20 mL盐酸时Na2CO3溶液和盐酸反应生成碳酸氢钠溶液,故B正确;
C.pH≈5.6时,溶液浓度不变,溶液达到饱和,说明常温下CO2饱和溶液的pH约为5.6,故C正确;
D.根据图象分析,A点为碳酸钠和碳酸氢钠的混合溶液,且c(HCO3-)=c(CO32-),溶液呈碱性,则c(OH-)>c( H+),盐溶液水解程度较小,所以c(CO32-)>c(OH-),则离子浓度大小顺序是c(HCO3-)=c(CO32-)>c(OH-)>c( H+),故D错误;
故选D.
点评 本题考查了离子浓度大小的比较,为高频考点,侧重于学生的分析能力的考查,注意根据物料守恒、电荷守恒来分析解答,难点是D,注意把握图象曲线的变化特点,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
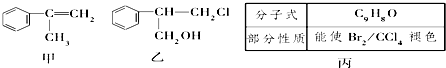
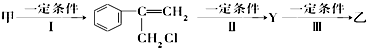
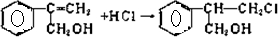 (不需注明反应条件).
(不需注明反应条件).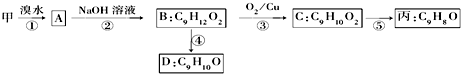
 .
. 、
、 、
、 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液 | 白色沉淀转化为红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| B | 常温下,相同的铝片分别投入足量的稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 向2mL 2%的CuSO4溶液中加入0.5mL 1%的NaOH溶液,振荡后加入几滴有机试剂X的溶液,加热 | 未出现砖红色沉淀 | 有机试剂X中不含醛基 |
| D | NaHCO3溶液与NaAlO2溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Ba2+、OH-、SO42- | B. | Ca2+、H+、Cl-、CO32- | ||
| C. | H+、Ba2+、Ag+、Cl- | D. | K+、OH-、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
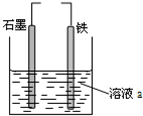
| A. | 若两电极直接连接,a是食盐水,则发生析氢腐蚀 | |
| B. | 若铁接电源负极,石墨接电源正极,a是稀H2SO4溶液,电解一段时间后溶液的pH增大 | |
| C. | 若两电极直接连接,则电子从铁流向石墨 | |
| D. | 若铁接电源正极,石墨接电源负极,a是氯化铜溶液,阴离子向石墨电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入BaCl2溶液,看是否有沉淀生成 | B. | 将水加热煮沸,看是否有沉淀生成 | ||
| C. | 加入NaOH溶液,看是否有沉淀生成 | D. | 加入少量肥皂水,看是否有沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
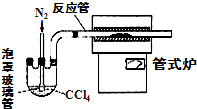 铬主要以铁合金(如铬铁)形式用于生产不锈钢及各种合金钢,铬元素形成的化合物很多,常见的有Cr2O3、CrCl3、H2CrO4,、H2Cr2O7等,请回答下列问题:
铬主要以铁合金(如铬铁)形式用于生产不锈钢及各种合金钢,铬元素形成的化合物很多,常见的有Cr2O3、CrCl3、H2CrO4,、H2Cr2O7等,请回答下列问题: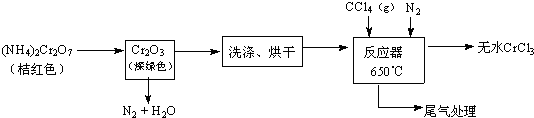
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com