
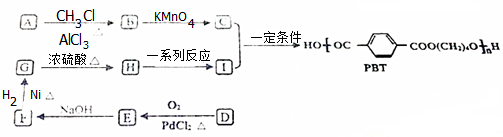
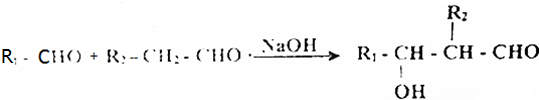
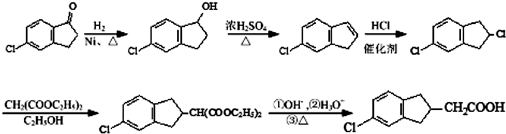
分析 D的产是为一个国家石油化工发展水平的重要标志,则D为CH2=CH2,D氧化得E为CH3CHO,E发生信息③中的反应生成F为CH3CHOHCH2CHO,F与氢气加成得G为CH3CHOHCH2CH2OH,G发生消去反应生成H为CH2=CHCH=CH2,根据PBT的结构可知,G经过一系列反应生成H为HOCH2CH2CH2CH2OH,则C为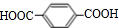 ,分子中所有的原子都处于同一个平面,根据转化关系,A为
,分子中所有的原子都处于同一个平面,根据转化关系,A为 ,A与一氯甲烷发生取代反应生成B为
,A与一氯甲烷发生取代反应生成B为 ,B发生氧化反应生成C,据此答题.
,B发生氧化反应生成C,据此答题.
解答 解:D的产是为一个国家石油化工发展水平的重要标志,则D为CH2=CH2,D氧化得E为CH3CHO,E发生信息③中的反应生成F为CH3CHOHCH2CHO,F与氢气加成得G为CH3CHOHCH2CH2OH,G发生消去反应生成H为CH2=CHCH=CH2,根据PBT的结构可知,G经过一系列反应生成H为HOCH2CH2CH2CH2OH,则C为 ,分子中所有的原子都处于同一个平面,根据转化关系,A为
,分子中所有的原子都处于同一个平面,根据转化关系,A为 ,A与一氯甲烷发生取代反应生成B为
,A与一氯甲烷发生取代反应生成B为 ,B发生氧化反应生成C,
,B发生氧化反应生成C,
(1)根据上面的分析可知,A的结构简式为 ,B为
,B为 ,B的核磁共振氢谱有2个峰,
,B的核磁共振氢谱有2个峰,
故答案为: ;2;
;2;
(2)为CH2=CH2,工业上获得D的主要途径是石油的裂解,
故答案为:油的裂解;
(3)F为CH3CHOHCH2CHO,F中所含的官能团的名称为羟基和醛基,G为CH3CHOHCH2CH2OH,G的名称为1,3-丁二醇,
故答案为:羟基和醛基;1,3-丁二醇.
点评 本题考查有机物推断与合成,掌握各类官能团的相互转化是推断关键,再结合转化关系及各物质的结构特点进行推断,对学生的逻辑推理有较高的要求,需要学生具备扎实的基础,难度中等.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
 如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8.工作时,需先引发铁和氯酸钾反应使共晶盐融化.已知:Li熔点181℃,LiCl-KCl共晶盐熔点352℃.下列说法正确的是( )
如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8.工作时,需先引发铁和氯酸钾反应使共晶盐融化.已知:Li熔点181℃,LiCl-KCl共晶盐熔点352℃.下列说法正确的是( )| A. | 整个过程的能量转化只涉及化学能转化为电能 | |
| B. | 放电时正极反应为:Li1+xV3O8-xe?═LiV3O8+xLi+ | |
| C. | 放电时Cl?移向LiV3O8电极 | |
| D. | Li-Si合金熔点高于352℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 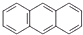 (蒽)和 (蒽)和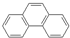 (菲)两者互为同分异构体,因1H-NMR谱(核磁共振氢谱)显示两者均有三种不同的氢原子,且比例均为2:2:1,故不能用1H-NMR谱鉴别它们 (菲)两者互为同分异构体,因1H-NMR谱(核磁共振氢谱)显示两者均有三种不同的氢原子,且比例均为2:2:1,故不能用1H-NMR谱鉴别它们 | |
| B. | 一般不能使用过酸的洗涤剂洗涤棉织品和丝织品,不能使用过碱的洗涤剂洗涤氨纶(聚氨基甲酸酯纤维)、腈纶(聚丙烯腈)等合成纤维制品 | |
| C. | 异黄酮类物质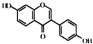 和酚类物质 和酚类物质 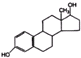 是具有生理活性的雌激素,它们的共同点是均能与钠单质和碳酸钠反应,且均含三种具有特殊活性的官能团(本题中醇羟基和酚羟基视为性质不同的官能团) 是具有生理活性的雌激素,它们的共同点是均能与钠单质和碳酸钠反应,且均含三种具有特殊活性的官能团(本题中醇羟基和酚羟基视为性质不同的官能团) | |
| D. | 一定条件下将总质量相等的CH3OH、CH3COOH混合物或HCOOH、HOCOOCH2OH混合物在氧气中完全燃烧,燃烧后的全部产物通入足量过氧化钠层,过氧化钠层增加的质量之比为23:15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
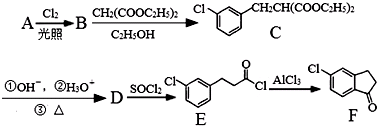
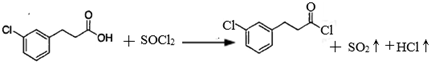 .
.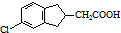 的合成路线流程图(注明反应条件).合成路线流程图示例如下:
的合成路线流程图(注明反应条件).合成路线流程图示例如下: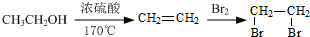
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用规格为100mL的量筒量取89.7mL蒸馏水 | |
| B. | 用容量瓶配制一定物质的量浓度的溶液前需用标准液润洗 | |
| C. | 打开分液漏斗、长颈漏斗、滴液漏斗的活塞,均可放出其中液体 | |
| D. | 锥形瓶、烧杯、烧瓶均可垫加石棉网加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:W>Z>Y>X | |
| B. | W和M形成的化合物是离子化合物 | |
| C. | 五种元素中只有X存在同素异形体 | |
| D. | 工业上采用电解W和Z形成的化合物制备W单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
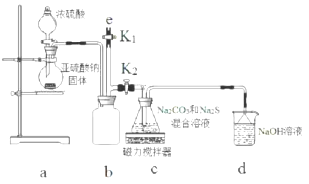
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.50 | 20.40 |
| 第二次 | 20.00 | 1.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池放电时,通入肼的一极为负极 | |
| B. | 电池每释放1molN2转移的电子数为4NA | |
| C. | 电池工作一段时间后,电解质溶液的pH将不变 | |
| D. | 通入空气的一极的电极反应式是:O2+2H2O+4e-=4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com