
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 为元素周期表中前20号元素,其原子序数依次增大。其中
为元素周期表中前20号元素,其原子序数依次增大。其中![]() 、
、![]() 是金属元素;
是金属元素;![]() 和
和![]() 同主族,它们原子的最外层电子排布式均为
同主族,它们原子的最外层电子排布式均为![]() ;
;![]() 和
和![]() 同主族,它们原子最外层的
同主族,它们原子最外层的![]() 能级电子数是
能级电子数是![]() 能级电子数的2倍;
能级电子数的2倍;![]() 元素原子最外层电子数是
元素原子最外层电子数是![]() 元素原子最外层电子数的
元素原子最外层电子数的![]() 。已知五种元素的电负性为2.5、3.5、0.8、2.1、1.5,请回答下列问题:
。已知五种元素的电负性为2.5、3.5、0.8、2.1、1.5,请回答下列问题:
(1)![]() 是______(填元素符号,下同),
是______(填元素符号,下同),![]() 是______,
是______,![]() 是______,
是______,![]() 是______,
是______,![]() 是______。
是______。
(2)五种元素中金属性最强的是______(填元素符号,下同),非金属性最强的是______。
(3)当![]() 与
与![]() 、
、![]() 、
、![]() 分别形成化合物时,
分别形成化合物时,![]() 显______(填“正”或“负”,下同)价,其他元素显______价。
显______(填“正”或“负”,下同)价,其他元素显______价。
(4)当![]() 与
与![]() 、
、![]() 、
、![]() 、
、![]() 分别形成简单化合物(其中
分别形成简单化合物(其中![]() 、
、![]() 、
、![]() 、
、![]() 均显最高价,
均显最高价,![]() 显最低负价)时,化合物中含有离子键的是______(填化学式,下同),含有共价键的是______。
显最低负价)时,化合物中含有离子键的是______(填化学式,下同),含有共价键的是______。
【答案】![]()
![]()
![]()
![]()
![]()
![]()
![]() 负 正
负 正 ![]() 、
、![]()
![]() 、
、![]()
【解析】
A、B、C、D、E5种元素核电荷数依次增大,且都小于20,B和D属同一族,由题意知最外层电子排布为ns2np4,处于ⅥA族,原子序数D>B,所以B为O元素、D为S元素;A和E属同一族,最外层电子排布为ns1,处于ⅠA族,E是金属元素,则A为H元素,E原子序数大于S,故E为K;C最外层上电子数等于D最外层上电子数的一半,原子序数大于氧、小于硫,故C为Al;据此解答。
(1)由上述分析可知,A为H元素,B为O元素,C为Al元素,D为S元素,E为K元素;
(2)金属元素的电负性越小,金属性越强,非金属元素的电负性越大,非金属性越强。K的电负性最小,所以金属性最强,O的电负性最大,非金属性最强;
(3)当O与H、Al、S形成化合物时,由于O的电负性大,所以O显负价,其他元素为正价;
(4)当O与H、Al、S、K形成化合物,且O显-2价,其他四种元素显最高价时,化合物Al2O3、K2O中有离子键;H2O、SO3中含有共价键。


科目:高中化学 来源: 题型:
【题目】在一定温度下,等容密闭容器中进行可逆反应:A(g)+2B(s)![]() 3C(g),下列叙述中,不是该反应达到平衡的标志的是( )
3C(g),下列叙述中,不是该反应达到平衡的标志的是( )
A.A、B、C的分子数目比为1:2:3B.容器内压强不再变化
C.单位时间生成lmolA,同时消耗2molBD.C的生成速率与C的分解速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其分子式为C8H8O2,相对分子质量为 136,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环,且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图。关于A的下列说法中不正确的是( )
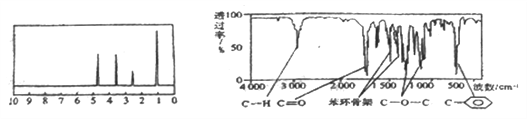
A. A分子属于酯类化合物,在一定条件下能发生水解反应
B. A在一定条件下可与3 mol H2发生加成反应
C. 符合题中A分子结构特征的有机物只有一种
D. 与A属于同类化合物的同分异构体只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。请回答以下问题:

(1)认真分析上图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小(最小)范围为________<Al<________(填元素符号)。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是________。
(3)上图中第一电离能最小的元素在周期表中的位置是________。
(4)根据对角线规则,Be、Al元素最高氧化物的水化物性质相似,它们都具有________,其中Be(OH)2显示这种性质的离子方程式是 __________________________、_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图.下列说法正确的是( )
![]()
A.x<yB.SO2是该反应的催化剂
C.MFe2Ox是还原剂D.氧化性:MFe2Oy>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) ΔH1
②2H2O(l)=2H2(g)+O2(g) ΔH2
③2H2O2(l)=2H2O(l)+O2(g) ΔH3
④Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH4
则ΔH4的正确表达式为( )
A.ΔH4=ΔH1+![]() ×ΔH2+
×ΔH2+![]() ×ΔH3B.ΔH4=ΔH1+
×ΔH3B.ΔH4=ΔH1+![]() ×ΔH2—
×ΔH2—![]() ×ΔH3
×ΔH3
C.ΔH4=ΔH1+2×ΔH2—2×ΔH3D.ΔH4=2×ΔH1+ΔH2+ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg 电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH 增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和压强下,对反应CO2(g)+H2(g)![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
| CO2 | H2 | CO | H2O |
甲 | amol | amol | 0mol | 0mol |
乙 | 2amol | amol | 0mol | 0mol |
丙 | 0mol | 0mol | amol | amol |
丁 | amol | 0mol | amol | amol |
上述四种情况达到平衡后,n(CO)的大小顺序是
A. 乙=丁>丙=甲B. 乙>丁>甲>丙
C. 丁>乙>丙=甲D. 丁>丙>乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是
A.除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2++Cl2=2Fe3++2Cl-
B.检验丙烯醛CH2=CHCHO中含有碳碳双键:CH2=CHCHO+Br2→CH2Br-CHBr-CHO
C.向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4+NH3·H2O+H2O
D.向含有0.1 mol溶质的硫酸亚铁稀溶液中加入7.8 g Na2O2:Na2O2+4Fe2++6H2O=4Fe(OH)3+8Na++O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com