
答案 AC
解析 H2O分子中的中心原子O为sp3杂化,H2O的空间构型为V形;H2SO4分子中氢原子没有发生轨道杂化。
★ ★★
答案 (1)平面三角形 三角锥形
(2)CH≡CH CH2===CH2、 CH3CH3
CH3CH3
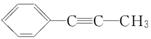 (其他合理答案均可)
(其他合理答案均可)
(3)CH4分子中的C原子没有孤电子对,NH3分子中N原子上有1对孤电子对,H2O分子中O原子上有2对孤电子对,对成键电子对的排斥作用增大,故键角减小
(4)AgF>AgCl>AgBr>AgI
解析 (1)BF3分子中的B原子采取sp2杂化,所以其分子的立体结构为平面三角形;NF3分子中的N原子采取sp3杂化,其中一个杂化轨道中存在一对孤电子对,所以其分子的立体结构为三角锥形。
(2)乙烷分子中的碳原子采取sp3杂化,乙烯、苯分子中的碳原子均采取sp2杂化,乙炔分子中的碳原子采取sp杂化,同时含有三种不同杂化方式的碳原子的有机物分子中应该同时含有烷基(或环烷基)、碳碳双键(或苯环)和碳碳三键。
(3)H2O、NH3、CH4分子中的O、N、C均采取sp3杂化,而在O原子上有2对孤电子对,对成键电子对的排斥作用最大,键角最小;N原子上有1对孤电子对,对成键电子对的排斥作用使键角缩小,但比水分子的要大;C原子上无孤电子对,键角最大。
★ ★★


科目:高中化学 来源: 题型:
2NO(g)+O2(g)2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。
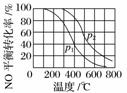
①比较p1、p2的大小关系:________。
②随温度升高,该反应平衡常数变化的趋势是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于配位化合物的叙述中,不正确的是( )
A.配位化合物中必定存在配位键
B.配位化合物中只有配位键
C.[Cu(H2O)6]2+中的Cu2+提供空轨道,H2O中的氧原子提供孤对电子形成配位键
D.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有着广泛的应用
查看答案和解析>>
科目:高中化学 来源: 题型:
若在宇宙飞船的太空实验室(失重条件下)进行以下实验,其中最难完成的是( )
A.将金粉和铜粉混合
B.将牛奶加入水中混合
C.蒸发食盐水制取食盐晶体
D.用漏斗、滤纸过滤除去水中的泥沙
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.以非极性键结合起来的双原子分子一定是非极性分子
B.以极性键结合起来的分子一定是极性分子
C.非极性分子只能是双原子单质分子
D.非极性分子中,不一定含有非极性共价键
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO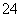 、NO
、NO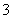
B.可用稀硝酸除去试管内壁上的银镜
C.1.0 mol·L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO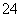
D.硫化铜溶于硝酸的离子方程式为CuS+2H+===H2S↑+Cu2+
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第________周期第________族;PbO2的酸性比CO2的酸性________(填“强”或“弱”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com