
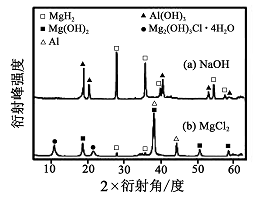
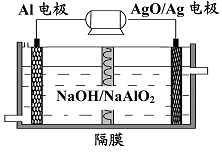


科目:高中化学 来源:不详 题型:推断题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.汽油、柴油、植物油都属烃类物质且均为纯净物 |
| B.单质硅常用于制造芯片和光导纤维 |
| C.等质量的气态乙醇和液态乙醇分别完全燃烧,前者放出的热量更多 |
| D.漂白精和明矾都常用于自来水的处理,二者作用原理相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe Cu Al Ag Mg | B.Al Cu Mg Ag Fe |
| C.Mg Cu Al Ag Fe | D.Mg Ag Al Cu Fe |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 装 置 | 现 象 |
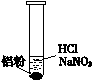 | ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,液面上方呈浅棕色 ⅲ. 试管变热,溶液沸腾 |
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI—淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI—淀粉试纸检验浅棕色气体 | 试纸变蓝 |
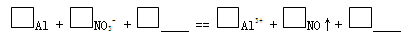
| 装 置 | 现 象 |
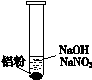 | ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,有刺激性气味 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.相同条件下,产生气体的体积相等 |
| B.生成的铝的化合物的物质的量相等 |
| C.消耗酸和碱的物质的量相等 |
| D.相同条件下,转移的电子数相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
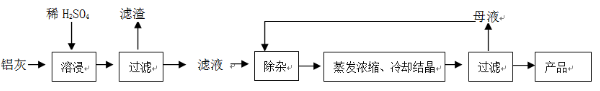
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HNO3溶液 | B.Ba(OH)2溶液 | C.H2SO4溶液 | D.HCl溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3 mol·L-1 HCl溶液 | B.4 mol·L-1 HNO3溶液 |
| C.8 mol·L-1 NaOH溶液 | D.18 mol·L-1 H2SO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com