
| A. | 在相同条件下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度不相同 | |
| B. | 反应NH3(g)+HCl(g)?NH4Cl(s)能自发进行,则该反应△H<0 | |
| C. | 锌与稀硫酸反应时加入少量硫酸铜,反应加快的主要原因是Cu2+水解增大了 c(H+) | |
| D. | 一定条件下,反应2SO2(g)+O2(g)?2SO3(g)△H<0达到平衡后,升高体系温度,应重新达到平衡前,有v正(O2)>2v逆(SO2) |
分析 A.醋酸抑制水的电离,氯化铵促进水的电离;
B.NH3(g)+HCl(g)?NH4Cl(s)的△S<0,△H-T△S<0的反应可自发进行;
C.锌与稀硫酸反应时加入少量硫酸铜,Zn置换出Cu,构成原电池;
D.△H<0,为放热反应,达到平衡后,升高体系温度,平衡逆向移动.
解答 解:A.醋酸抑制水的电离,氯化铵促进水的电离,则pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度不相同,故A正确;
B.NH3(g)+HCl(g)?NH4Cl(s)的△S<0,△H-T△S<0的反应可自发进行,可知该反应△H<0,故B正确;
C.锌与稀硫酸反应时加入少量硫酸铜,Zn置换出Cu,构成原电池,可加快反应速率,与水解无关,故C错误;
D.△H<0,为放热反应,达到平衡后,升高体系温度,平衡逆向移动,则重新达到平衡前,有v正(O2)<2v逆(SO2),故D错误;
故选AB.
点评 本题考查反应热与焓变,为高频考点,把握反应进行方向、水解与电离、平衡移动为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 电子由Al电极通过外电路流向Ag2O/Ag电极 | |
| B. | 电池负极附近溶液pH升高 | |
| C. | 正极反应式为:Ag2O+2e-+H2O=2Ag+2OH- | |
| D. | 负极会发生副反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3水解的离子方程式:HCO3-+H2O?CO32-+H2O- | |
| B. | Ca(OH)2的电离方程式:Ca(OH)2?Ca2++2OH- | |
| C. | AgCl 的沉淀溶解平衡表达式:AgCl(s)?Ag+(aq)+CI“(aq) | |
| D. | Na2S 水解的离子方程式:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质编号 | 物质转化关系 | a | b | c | d |
| ① | 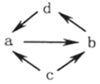 | NO | NO2 | N2 | HNO3 |
| ② | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
| ③ | SiO2 | Na2SiO3 | Si | H2SiO3 | |
| ④ | SO2 | SO3 | S | H2SO4 |
| A. | ①② | B. | ②③ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| B. | 新制氯水中:Cl2+H2O?2H++ClO-+Cl- | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
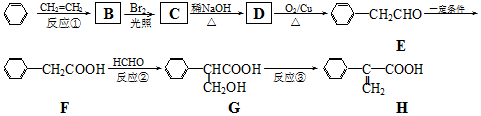
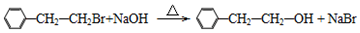 .
.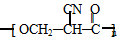 (要重新写过) 的合成路线:NCCH2CHO$→_{△}^{新制Cu(OH)_{2}}$ $\stackrel{H+}{→}$
(要重新写过) 的合成路线:NCCH2CHO$→_{△}^{新制Cu(OH)_{2}}$ $\stackrel{H+}{→}$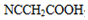 →
→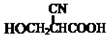 →
→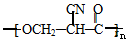 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com