
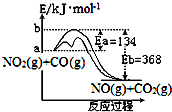
 已知某反应的能量变化如图.在不同温度下,反应物初始浓度与初始反应速率有如表关系.
已知某反应的能量变化如图.在不同温度下,反应物初始浓度与初始反应速率有如表关系.| 实验序号 | 1 | 2 | 3 | 4 | |
| c(NO2)/mol•L-1 | 1 | 1 | 2 | 2 | |
| c(CO)/mol•L-1 | 1 | 2 | 1 | 2 | |
| v/mol•L-1•s-1 | 750K | p | 2p | 2p | 4p |
| 500K | q | q | 4q | 4q | |
| A. | 不同温度下,增加反应物的浓度不一定可以加快反应速率 | |
| B. | 加入催化剂,改变了反应的途径,加快了反应速率 | |
| C. | 升高反应温度,加快了反应速率,增大了平衡常数 | |
| D. | 750K时,将实验2的容器体积缩小一半,速率v为8p mol•L-1•s-1 |
分析 反应物总能量大于生成物总能量,正反应为放热反应,则升高温度,平衡逆向移动,升高温度、增大浓度、压强以及加入催化剂都可增大反应速率,以此解答该题.
解答 解:A.如降低温度,增大浓度,则反应速率不一定增大,故A正确;
B.加入催化剂,降低反应的活化能,改变了反应的途径,加快了反应速率,故B正确;
C.正反应为放热反应,升高温度,平衡逆向移动,则平衡常数减小,故C错误;
D.750K时,将实验2的容器体积缩小一半,NO2和CO浓度都增大一倍,由表中数据可知速率v为8p mol•L-1•s-1,故D正确.
故选C.
点评 本题考查化学平衡的建立以及反应速率的影响因素,为高频考点,侧重于学生的分析能力的考查,易错点为D,注意浓度与速率的关系,难度中等.


科目:高中化学 来源: 题型:多选题
| A. | CuCl2、Cu(NO3)2、Ba(OH)2 | B. | Al、Fe、CuSO4 | ||
| C. | MgSO4、Mg(NO3)2、Ba(OH)2 | D. | Al、Cu、FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有醛中都含醛基和烃基 | |
| B. | 一元醛的分子式符合CnH2nO的通式 | |
| C. | 醛的官能团是-COH | |
| D. | 所有醛都能使溴水和酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 熔点℃ | 沸点℃ | 溶解性 | ||
| 水 | 醇 | 醚 | |||
| 浓硫酸 | 10.35 | 340 | 互溶 | 互溶 | 互溶 |
| 乙醚 | -89.12 | 34.5 | 微溶(在盐溶液中溶解度降低) | 互溶 | 互溶 |
| 乙醇 | -114.5 | 78.4 | 极易溶 | 极易溶 | 极易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaOH溶液中加入铝粉来制备H2:Al+2OH-+2H2O═AlO2-+3H2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 实验室用氢氧化钠溶液吸收Cl2:Cl2+OH-═Cl-+ClO-+H2O | |
| D. | 用胃舒平治疗胃酸过多:Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NH4Cl溶液蒸干灼烧制备NH4Cl固体 | |
| B. | 只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 | |
| C. | 用可见光束照射以区别溶液和胶体 | |
| D. | 用分液的方法分离酒精和水的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com