
| A、溶液的PH值增大;碳酸钠溶液的水解程度减小 |
| B、Na+和CO32-的浓度都减小 |
| C、阴极与阳极析出的气体物质的量之比为1:2 |
| D、溶液的浓度不变,有晶体析出 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、AB |
| B、AB2 |
| C、AB3 |
| D、A2B3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
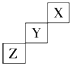 短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法中正确的是( )
短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法中正确的是( )| A、Z可能是活泼金属元素 |
| B、X的最高价氧化物对应的水化物是一种强酸 |
| C、Y元素原子的最外层电子数为7 |
| D、Z的最高价氧化物对应水化物的化学式为HZO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L H2O含有的分子数等于0.1NA |
| B、常温下,100 mL 1mol/L Na2CO3溶液中钠离子总数为0.1NA |
| C、分子数为NA的CO、N2混合气体体积约为22.4L,质量为28g |
| D、24g O2分子和24g O3分子所含的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、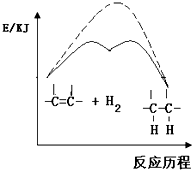 说明烯烃与H2的加成反应是放热反应,虚线表示在有催化剂的条件下表示 |
B、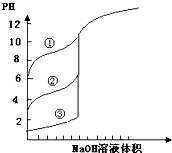 用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,曲线可确定①的酸性最强 |
C、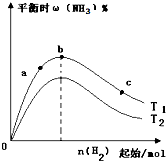 表示合成氨反应在其他条件不变的情况下,改变起始n(H2)对平衡的影响.由此可知,N2转化率最高的是b点;且T1>T2,K2>K1(T1和T2 表示温度,K1、K2表示对应温度下的平衡常数) |
D、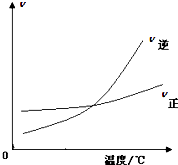 表示可逆反应“A2(g)+3B2 (g)?2AB3(g)”△H小于0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E | F |
 |
 |
 |
 |
 |
 |
| 1号试管 | 2号试管 | |
| 所加试剂 | 2mL0.10mol/L H2C2O4 溶液, 几滴稀硫酸,4mL0.010mol/L 的KMnO4溶液 |
2mL0.10mol/L H2C2O4 溶液,几 滴稀硫酸,4mL0.010mol/L的 KMnO4溶液,少量MnSO4固体. |
| 褪色时间 | 31秒 | 4秒 |
| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L-1) | 0.8 | 1.0 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试管编号 | 加3%Na2S2O3溶液/ml | 加H2O/ml | 加H2SO4(1:5)/滴 | 出现浑浊所用时间/s |
| ① | 3 | 3 | 5 | a |
| ② | 4 | 2 | 5 | b |
| ③ | 5 | 1 | 5 | c |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com