
| A. | 只有①② | B. | 只有③④ | C. | 只有①③ | D. | ①②③④ |
分析 ①分馏时测定馏分的温度;
②乙炔、H2S均能被高锰酸钾氧化;
③苯和溴水不反应;
④苯和硝基苯混合物不分层.
解答 解:①分馏时测定馏分的温度,则温度计不能插入受热的液体中,应将温度计水银球在烧瓶的支管口处,故错误;
②乙炔、H2S均能被高锰酸钾氧化,则不能除杂,应用硫酸铜溶液除去乙炔中含有的H2S,故错误;
③苯和溴水不反应,应将苯和液溴混合后加入铁粉制取溴苯,故错误;
④苯和硝基苯混合物不分层,不能分液分离,应选蒸馏法,故错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、有机物的制备等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
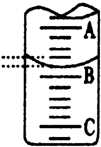 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
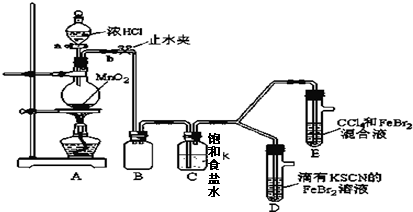
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后 关闭活塞a,点燃酒精灯. (填具体实验操作) | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,下层CCl4层无明显变化.一段时间后CCl4层由无色变为橙色.(填实验现象) | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
| ⅰ.Fe3++3SCN-?Fe(SCN)3 是一个可逆反应. ⅱ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. |
| ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应. ⅳ.AgClO、AgBrO均可溶于水. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
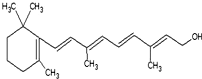 (1)重要的饱和一元脂肪醛有甲醛,其质量分数在35%~40%的水溶液俗称福尔马林.化学性质与乙醛相似,能被氢气还原成甲醇,能被O2、高锰酸钾酸性溶液、溴水、银氨溶液、新制的Cu(OH)2氧化,写出乙醛与银氨溶液反应的方程式CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag+3NH3+H2O.
(1)重要的饱和一元脂肪醛有甲醛,其质量分数在35%~40%的水溶液俗称福尔马林.化学性质与乙醛相似,能被氢气还原成甲醇,能被O2、高锰酸钾酸性溶液、溴水、银氨溶液、新制的Cu(OH)2氧化,写出乙醛与银氨溶液反应的方程式CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag+3NH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两原子之间形成共价键时,可形成2个σ键 | |
| B. | 将铁制品做炊具,金属键没有被破坏 | |
| C. | 温度越高,金属的导电性越好 | |
| D. | 任何晶体都含化学键. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
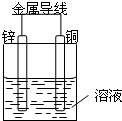 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
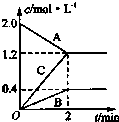 如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锗不能与强碱溶液反应 | B. | 氢氧化锗有两性 | ||
| C. | 氧化锗易溶于水 | D. | 氧化锗的化学式为Ge2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li是负极,电极反应为Li+e-=Li+ | |
| B. | Li是正极,电极反应为Li+e-=Li- | |
| C. | MnO2是负极,电极反应为MnO2+e-=MnO2- | |
| D. | 锂电池是一种环保型电池 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com