
| A | B | C | D | |
| 方案 | 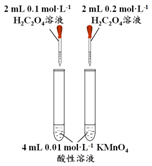 | 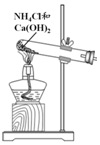 | 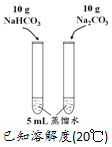 NaHCO3:9.6 g Na2CO3:21.8 g | 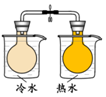 将NO2球浸泡在冷水和热水中 |
| 目的 | 探究浓度对化学反应速率的影响 | 制备氨气 | 室温下比较NaHCO3和Na2CO3的溶解度 | 探究温度对化学平衡的影响 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.只有亚硫酸钠的浓度一个变量;
B.实验室中用氯化铵和氢氧化钙固体加热制备氨气,图示装置合理;
C.根据溶解度数据可知,两个试管中得到的都是饱和溶液,无法比较二者溶解度大小;
D.只有温度一个变量,由图可知,温度高颜色深.
解答 解:A.只有亚硫酸钠的浓度一个变量,图中装置可探究浓度对反应速率影响,故A正确;
B.氯化铵和氢氧化钙固体加热可制备氨气,图示装置合理,能够达到实验目的,故B正确;
C.5mL蒸馏水的质量约为5g,根据碳酸钠、碳酸氢钠的溶解度可知,10g碳酸钠、碳酸氢钠在5mL水中都形成了饱和溶液,无法判断二者溶解度大小,故C错误;
D.只有温度一个变量,由图可知,温度高颜色深,则图中装置可探究温度对化学平衡的影响,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及反应速率及平衡的影响因素、溶解度大小比较、气体制备等,把握反应原理、实验基本技能为解答的关键,注意实验装置的作用,侧重实验评价分析的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | v(C)=0.2mol•L-1•s-1 | B. | z=3 | ||
| C. | B的转化率为25% | D. | C平衡时的浓度为0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
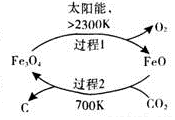 二氧化碳的回收利用是环保领域研究热点.
二氧化碳的回收利用是环保领域研究热点.
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3=Na++H++CO32- | B. | Fe2(SO4)3=2Fe3++3SO42- | ||
| C. | MgCl2=Mg2++2Cl- | D. | NaOH=Na++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 0.01mol•L-1 酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 1mol•L-1 MnSO4溶液 | 反应温度 /℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | v1mL | v2mL | 1mL | 0 | 20 | 320 |
| Ⅲ | v3mL | v4mL | v5mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和反应的反应热测定需用温度计测量温度二次,分别为反应的起始温度和最高温度 | |
| B. | 用试纸检验气体时,可先把试纸用蒸馏水润湿,粘在玻璃棒一端,用玻璃棒把试纸放到盛待测气体的容器口附近 | |
| C. | 用剩的药品能否放回原瓶,应视具体情况而定 | |
| D. | 将铂丝放在盐酸中洗涤并灼烧为无色后,再蘸取待测物进行焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 操作 | |
| A | 证明某溶液中存在Fe2+ | 先加少量氯水,再滴加KSCN溶液,出现血红色 |
| B | 测定熔融苛性钠的导电性 | 在瓷坩埚中熔化氢氧化钠固体后进行测量 |
| C | 证明氯的非金属性大于碳 | 向碳酸钙中滴加盐酸,有气泡产生 |
| D | 制备氯化镁晶体 | 将MgCl2溶液在氯化氢的气流中蒸干 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
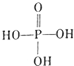
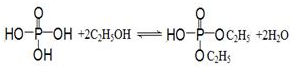 .
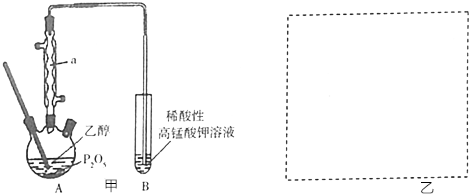
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com