

| A、从a点到b点,混合溶液不可能存在:c(Cl-)=c(NH4+) |
| B、由水电离的c(H+):b点>c点 |
| C、氨水的电离平衡常数:b点>a点 |
| D、b焦到c点,混合溶液中可能存在:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
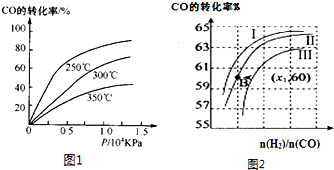
| n(H2) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y、Z、X、W的原子序数依次减小 |
| B、X的简单氢化物的沸点低于Y的简单氢化物的沸点 |
| C、由W、X、Y、Z四种元素组成的常见化合物可能显强酸性 |
| D、W与X可形成既含极性共价键又含非极性共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ |
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| C、少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O═C6H5OH+HSO3- |
| D、FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 分别向蛋白质溶液中滴加硫酸、烧碱溶液、饱和NH4Cl溶液、75%的乙醇溶液等 | 均有固体析出 | 均发生变性 |
| B | 向某溶液中滴加KMnO4 | 紫色褪去 | 原溶液中一定有Fe2+ |
| C | Fe与稀HNO3、稀H2SO4反应 | 产生气体 | 均发生置换反应 |
| D | 向AgCl悬浊液中滴加Na2S溶液 | 白色沉淀变成黑色 | 2AgCl(s)+S2-(aq)═Ag2S(s)+2Cl-(aq) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、溶液中c(H+)=
| ||
B、物质的量浓度c(HA)=
| ||
C、t℃时,HA的溶解度S=
| ||
D、HA的质量分数w(HA)=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
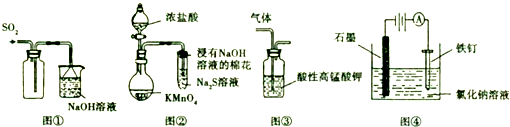
| A、可用图①所示装置收集SO2 |
| B、可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱 |
| C、可用图③所示装置除去CH4中混有的少量C2H4 |
| D、可用图④所示装置防止铁钉生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
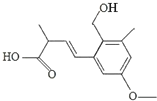 某有机物的结构简式如图,下列叙述正确的是( )
某有机物的结构简式如图,下列叙述正确的是( )| A、该有机物的分子式为C14H20O4 |
| B、该有机物能发生取代、加成和聚合反应 |
| C、1mol该有机物最多能与3mol NaOH反应 |
| D、该有机物分子中所有碳原子一定共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.| [NH3?H2O] | ||
[N
|
| 5.56 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com