
分析 一定温度下,水存在电离平衡H2O(l)?H+(aq)+OH-(aq)△H>0,升高温度或加入能与H+或OH-反应的离子,可促进水的电离,如加入酸或碱,溶液中H+或OH-浓度增大,则抑制水的电离,以此解答该题.
解答 解:①100℃的纯水;②25℃0.1mol/LHCl溶液;③25℃0.1mol/LKOH溶液;④25℃0.1mol/LBa(OH)2溶液,
一定温度下,水存在电离平衡H2O(l)?H+(aq)+OH-(aq)△H>0,
这些物质与25℃纯水相比,能促进水的电离的是升高温度,因水的电离为吸热反应;
加入酸、碱溶液可抑制水的电离,即②③④抑制水的电离;
水电离的c(OH-)水等于溶液中c(OH-),可为中性溶液或酸溶液,如纯水、盐酸等,①②符合;
水电离的c(H+)水等于溶液中c(H+),可为中性溶液或碱溶液,如纯水、氢氧化钾、氢氧化钡溶液,①③④符合;
以上可得出一个结论,纯水中加入酸、碱,可抑制水的电离.
故答案为:①;②③④;①②;①③④;抑制.
点评 本题考查了水的电离及其影响因素,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意掌握水的电离及影响,明确酸碱溶液抑制水的电离.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑥⑦ | B. | ②③④⑤ | C. | ①②④⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅燃烧产物对环境产生的污染,容易得到有效控制 | |
| B. | 硅燃烧可以放出较多的热量 | |
| C. | 自然界中硅的贮存量丰富,可以从自然界直接获得单质硅 | |
| D. | 硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
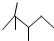 ,有机物 B 与等物质的量的 H2发生加成反应可得到有机物 A.则:
,有机物 B 与等物质的量的 H2发生加成反应可得到有机物 A.则:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
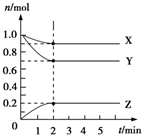 Ⅰ.控制变量法是化学实验的一种常用方法.如表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
Ⅰ.控制变量法是化学实验的一种常用方法.如表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
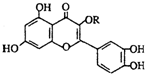 唐山市的市树是国槐,天然维生素P(结构如图)存在于国槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述正确的是( )
唐山市的市树是国槐,天然维生素P(结构如图)存在于国槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述正确的是( )| A. | 若R为甲基则该物质的分子式可以表示为C16H10O7 | |
| B. | 分子中有三个苯环 | |
| C. | lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol | |
| D. | lmol该化合物最多可与2molBr2完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器中SO2、O2、SO3共存 | |
| B. | SO2与SO3的浓度相等 | |
| C. | 容器中SO2、O2、SO3的物质的量之比为2:1:2 | |
| D. | 反应容器中压强不随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3的水溶液可以导电,说明NH3是电解质 | |
| B. | 海带中的碘为碘化钾,加硝酸银溶液有黄色沉淀产生 | |
| C. | 用酒精可萃取碘水中的碘单质 | |
| D. | 向淀粉碘化钾溶液中加入溴水,溶液变为蓝色,说明Br2的氧化性强于I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com