
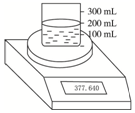
 如图所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:
如图所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:| 实验操作 | 时间/s | 电子天平读数/g |
| 烧杯+水 | 370.000 | |
| 烧杯+水+样品 | 0 | 377.640 |
| 30 | 376.920 | |
| 60 | 376.400 | |
| 90 | 376.200 | |
| 120 | 376.200 |
分析 由表中数据可知,烧杯与水的总质量为370.000g,加入样品后(0s)总质量为377.640g,故样品的质量为377.640g-370.000g=7.64g,由90s、120s的总质量可知,反应完全后总质量减少377.640g-376.200g=1.44g,质量减少为生成氧气的质量,根据n=$\frac{m}{M}$,计算氧气的物质的量,由2Na2O2+2H2O=4NaOH+O2↑中氧气的量进而计算样品中Na2O2的质量,并求其质量分数,并根据pH=-lgc(H+),据此进行计算;
解答 解:由表中数据可知,烧杯与水的总质量为370.000g,加入样品后(0s)总质量为377.640g,故样品的质量为377.640g-370.000g=7.64g,即m(Na2O2)+m(Na2O)=7.64g①,
又因为90s、120s的总质量可知,反应完全后总质量减少377.640g-376.200g=1.44g,质量减少为生成氧气的质量,故n(O2)=$\frac{m}{M}$=$\frac{1.44g}{32g/mol}$=0.045mol,
2Na2O2+2H2O=4NaOH+O2↑
156 4 1
m(Na2O2) n(NaOH)0.045
则:m(Na2O2)=7.02g②,n(NaOH)=0.18mol,
w(Na2O2)=$\frac{7.02g}{7.64g}×100%$=91.9%,
将②代入①得m(Na2O)=0.62g,
Na2O+H2O=2NaOH
62 2
0.62 0.02
则n总(NaOH)=0.18+0.02=0.2mol,n(OH-)=0.2mol,c(OH-)=$\frac{0.2}{0.2}$=1mol/L,c(H+)=$\frac{Kw}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{1}$=10-14,pH=-lgc(H+)=-lg10-14=14.
答:样品中的质量分数为91.9%,估算最后溶液的pH为14.
点评 本题考查混合物的有关计算,正确书写方程式是本题解题的关键,本题题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
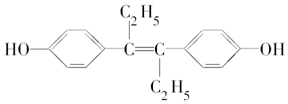
| A. | 可以使溴水褪色 | |
| B. | 该物质能发生氧化反应 | |
| C. | 1 mol该有机物可以与5 mol Br2发生反应 | |
| D. | 可与NaOH和NaHCO3溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y 单质可以在海水中提取 | B. | 单质氧化性:Y>Z | ||
| C. | 气态氢化物稳定性:HX<HZ | D. | 离子半径:X->Y- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{106(m-n)}{11m}$×100% | B. | $\frac{168(m-n)}{56m}$×100% | C. | $\frac{84(n-m)?}{11m}$×100% | D. | $\frac{?(n-m)?}{m}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Y>Z | |
| B. | 最高价氧化物对应水化物的酸性:W>X | |
| C. | 单质熔点:X>W>Y | |
| D. | q与p、r的化学键种类完全不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉水解的最终产物是麦芽糖 | |
| B. | 丙烯分子中三个碳原子处于同一直线上 | |
| C. | 二氯甲烷只有一种结构,可证明甲烷是正四面体构型 | |
| D. | 符合分子式为C4H10O能与金属钠反应的有机物有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化锂是一种电解质 | B. | LiH是离子晶体[ | ||
| C. | LiH是一种强氧化剂 | D. | LiH中Li+半径小于H-半径 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com