
分析 (1)a.①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol,
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol,
依据盖斯定律$\frac{①+②}{2}$得到;
b.原电池放电时,甲烷失电子被氧化反应;根据转移电子守恒分析解答;
(2)二氧化氮具有氧化性,亚硫酸钠具有还原性,根据氧化还原反应的规律知识来回答判断;
解答 (解:(1)a.①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol,
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol,
依据盖斯定律$\frac{①+②}{2}$得到CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol;
b.原电池放电时,甲烷失电子被氧化,应为电池负极反应,其电极反应式为:CH4+10OH--8e-=CO32-+7H2O;电池在放电过程中消耗氢氧根离子,所以溶液的pH减小;阳极产生64克铜,转移电子数为:$\frac{64g}{64g/mol}$×2=2mol,所以甲烷的物质的量为:$\frac{2}{8}$mol=0.25mol,则
体积为:0.25mol×22.4L/mol=5.6L,转移电子数为:2NA;故答案为:CH4+10OH--8e-=CO32-+7H2O;5.6;2NA;
(2)二氧化氮具有氧化性,亚硫酸钠具有还原性,二者之间会发生氧化还原反应:2NO2+4Na2SO3═N2+4Na2SO4,结合化学反应2NO+ClO2+H2O=NO2+HNO3+HCl知道,N2~2NO2~2ClO2,所以若生成11.2L即0.5molN2(标准状况),则消耗1molClO2质量是1mol×67.5g/mol=67.5g,故答案为:2NO2+4Na2SO3═N2+4Na2SO4,67.5g.
点评 本题考查了热化学方程式的书写和电化学反应中的相关计算,侧重考查学生对数据的分析处理,题目难度中等.


科目:高中化学 来源: 题型:解答题
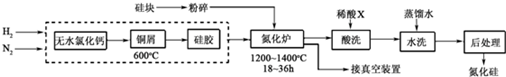
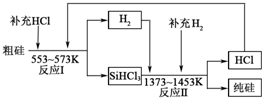
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,15g甲基(-CH3)所含的中子数为6NA | |
| B. | 一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为3NA | |
| C. | 在1L的碳酸钠溶液中,若c(CO32-)=1mol/L,则Na+个数为2NA | |
| D. | 含4NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中Na+的浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 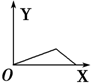 | B. | 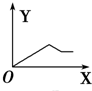 | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2(CuCl2) | B. | AgNO3(Ag2O) | C. | NaCl(NaCl) | D. | CuSO4[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
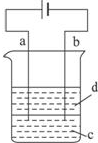 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤ | B. | ①③⑤ | C. | ③⑤ | D. | ①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com