
【题目】下列有关乙烯化学性质的说法,错误的是( )
A.乙烯能使酸性高锰酸钾溶液褪色,是由于乙烯发生了氧化反应
B.乙烯可在氧气中燃烧,该反应属于乙烯的氧化反应
C.将乙烯通入溴水中,反应后得到均一、透明的液体
D.乙烯能使溴的四氯化碳溶液褪色,该反应属于加成反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】尼泊金乙酯是一种高效食品防腐剂,被广泛应用于酱油、醋等调味品、烘焙食品以及果蔬保鲜等领域。下图是以苯等为原料合成尼泊金乙酯的合成路线:
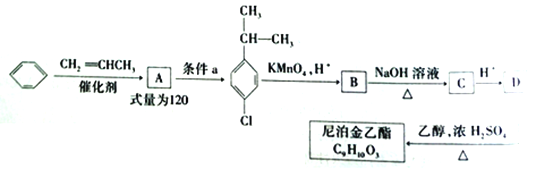
已知: 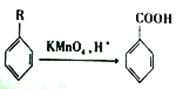 (R为烃基)
(R为烃基)
请回答有关问题:
(1)由苯生成A的反应类型是______,条件a指的是_____,化合物D中所含官能团的名称为____________。
(2)写出B→C 的化学方程式________________。
(3)尼泊金乙酯的结构简式为_________。
(4)化合物D的同分异构体中含有苯环且能发生银镜反应的有______种,其中核磁共振氢谱有4组峰的同分异构体的结构简式为_________(任写两种)。
(5)若以苯为原料( 其它原料自选)合成装苯甲酸甲酯,參照上述流程设计写出合成路线。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是( )

A. 原子半径:丙<丁<戊 B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊 D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨有“光明使者”的美誉,在自然界中主要以钨(+6价)酸盐的形式存在,黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe、Mn)WO4,钨酸(B)酸性很弱,难溶于水,黑钨矿传统冶炼工艺的第一阶段是碱熔法,第二阶段则是用还原剂还原出金属钨。化合物A、B、C含有同一元素。请回答下列问题:

(1)为提高水浸速率,采取的措施为___________________(写两种)。
(2)用还原剂还原出金属钨。
①碳和氢气均可还原化合物C得钨,用氢气比用碳更具有优点,其理由是___________。
②如果用金属铝与化合物C反应,还原出1mol钨至少需要铝的质量为___________。
(3)利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)![]() WI2(g) △H<0。
WI2(g) △H<0。
①一定温度下,向某恒容密闭容器中加入2molI2(g)和足量W(s)达平衡后,I2(g)的转化率为20%,则平衡时c[I2(g)]∶c[WI2(g)]=___________;相同条件下,若开始加入I2(g)的物质的量变为原来2倍,则下列数值是原来2倍的有___________(填标号)。
A.平衡常数 B.达到平衡的时间
C.I2(g)的物质的量浓度 D.平衡时WI2(g)的体积分数
②工业上利用上述反应原理提纯金属钨的示意图如右:

反应在真空石英管中进行,先在温度为T1端放入不纯W粉末和少量I2(g),一段时间后,在温度为T2的一端得到纯净的晶体,则温度T1___________T2(填:“>”、“<”或“=”)。
(4)写出黑钨矿中FeWO4在步骤Ⅰ中反应的化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 浓度相同的NaNO3溶液和HNO3溶液中NO3—化学性质相同
B. 等质量的红磷和白磷完全燃烧生成P2O5(s)放出热量相同
C. 可以通过化学反应将淀粉转化为乙酸
D. 所有加聚产物都不能与Br2(CCl4)发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.沸水中滴入FeCl3饱和溶液:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.一小块钠投入水中:Na+2H2O===Na++2OH-+H2↑
C.用氢氧化钠溶液吸收过量二氧化碳:OH-+CO2===HCO![]()
D.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-===2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市售照明材料LED晶片是一种发光二极管。材质组成为:GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、GaInN(氮化镓铟)等。请回答下列问题:
(1)砷基态原子的核外电子排布式为______________________。
(2)上述非金属元素氢化物的沸点从高到低的顺序为___________。
(3)下列说法正确的是___________
a.电负性:As<Ga b.SiC与GaAs互为等电子体 c.第一电离能:As>Se>Ga
(4)如图所示为GaAs的晶胞结构,晶体熔点为1237℃。
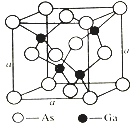
①晶胞中砷与镓原子间的化学键类型有___________。
②一个镓原子周围所有距离最近且相等的砷原子形成的空间构型是___________。
③一个晶胞的组成为___________。
④已知晶胞棱长a=5.64×10-10m,则该晶胞密度为ρ=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,用0.1000mol/L NaOH溶液滴定25.00mL 0.1000mol/L某一元酸HX溶液,滴定过程中pH变化曲线如下图所示。下列说法不正确的是( )

A. 在A点:c(HX)>c(Na+)>c(X-)
B. 在B点,溶液中c(H+)=c(OH-)
C. C点溶液中存在的主要平衡是X- + H2O![]() HX+OH-
HX+OH-
D. 0.05mol/L NaX溶液的pH ≈ 9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH固体配制一定物质的量浓度的NaOH溶液,下列操作中正确的是( )
A.称量时,将固体NaOH直接放在天平右盘上
B.将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解
C.将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中
D.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com