
分析 (1)存在的分子有H2O、H2A,则H2A为弱酸;
(2)等体积混合生成Na2A,水解显碱性,离子水解以第一步为主;由反应式Ba2++A2-=BaA↓可得:沉淀后A2-过量0.01mol,溶液中c(A2-)=$\frac{0.01mol}{30×1{0}^{-3}L}$=$\frac{1}{3}$mol•L-1,根据BaA的Ksp可得c(Ba2+);
(3)①弱酸电离,②中水解生成分子,③中等体积混合为等量的NaCl、NaHA、H2A,浓度均为0.01mol/L,抑制弱酸的电离;
(4)混合溶液c(H+)/c(OH-)=104,c(H+)=10-5mol/L,显酸性,则酸过量,以此分析.
解答 解:(1)存在的分子有H2O、H2A,则H2A为弱酸,电离方程式为H2A?H++HA-、HA-?H++A2-,故答案为:H2A?H++HA-、HA-?H++A2-;
(2)等体积混合生成Na2A,水解显碱性,pH>7,离子水解以第一步为主,则离子浓度关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+),由反应式Ba2++A2-=BaA↓可得:沉淀后A2-过量0.01mol,溶液中c(A2-)=$\frac{0.01mol}{30×1{0}^{-3}L}$=$\frac{1}{3}$mol•L-1,根据BaA的Ksp=c(Ba2+)•c(A2-)可得c(Ba2+)=$\frac{Ksp}{c({A}^{2-})}$=$\frac{1.8×1{0}^{-10}}{\frac{1}{3}}$=5.4×10-10 mol•L-1;
故答案为:>;c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+);5.4×10-10;
(3)①弱酸电离,②中水解生成分子,③中等体积混合为等量的NaCl、NaHA、H2A,浓度均为0.01mol/L,抑制弱酸的电离,则三种情况的溶液中H2A分子浓度最大的为③,最小的为②,②溶液pH大于③,①③相比①的酸性强,则pH最小,所以②>③>①,故答案为:③;②>③>①;
(4)混合溶液c(H+)/c(OH-)=104,c(H+)=10-5mol/L,显酸性,则酸过量,H2A为弱酸,pH=3的H2A溶液与pH=11的NaOH溶液混合时酸的浓度大于碱的浓度,则二者体积关系不确定,大于、小于或等于都可能酸过量,故答案为:均有可能.
点评 本题考查较综合,涉及酸碱混合的定性分析、pH、电离与水解、电离方程式等,把握溶液中的溶质及电离与水解的趋势、相互影响即可解答,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸不能盛放在玻璃试剂瓶中 | |
| B. | 由沙子制备光伏材料时的反应之一为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$ Si+2CO↑ | |
| C. | 灼烧NaOH固体时不能使用瓷坩埚,因为坩埚中的SiO2能与NaOH反应 | |
| D. | 玻璃、水晶、陶瓷的主要成分均是硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量大于生成物的总能量 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 应用盖斯定律,可计算出某些难以直接测量的反应的焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L氯气用氢氧化钠溶液充分吸收,反应中转移了0.5NA个电子 | |
| B. | 标准状况下分子总数为0.5 NA的H2O与CO2的总体积为11.2 L | |
| C. | 0.1 mol•L-1的NaCl溶液中含有0.1NA个Na+ | |
| D. | 2.3g钠与足量的水反应产生氢气的分子数为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH在水中显碱性 | |
| B. | NaH中氢离子电子层排布与氦原子相同 | |
| C. | NaH中氢离子半径比锂离子半径大 | |
| D. | NaH中氢离子被还原为H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
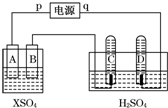 如图,p、q为直流电源两极,A为+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
如图,p、q为直流电源两极,A为+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成气体 体积(cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阳极生成气体 | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
| 体积(cm3) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
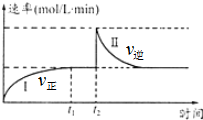 在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(
在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(| A. | 0~t2时,v正>v逆 | |
| B. | t2时刻改变的条件可能是加催化剂 | |
| C. | Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ | |
| D. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数I<Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的结构简式:C2H6O | |
| B. | 硫离子的结构示意图: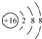 | |
| C. | 氮气的电子式: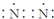 | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2═Ba2++(OH-)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com