
| A. | NaCl和Na2S | B. | HCl和NH3 | C. | AlCl3和H2O | D. | CH4和Na2O |
科目:高中化学 来源: 题型:实验题
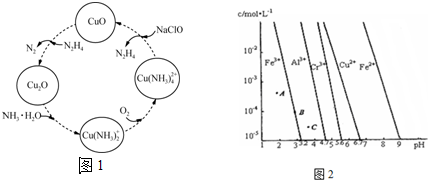
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用含磷洗涤剂 | B. | 用O3替代Cl2作饮用水消毒剂 | ||
| C. | 用工业污水直接灌溉农田 | D. | 含CuSO4的废水直接排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用盐酸酸化的BaCl2溶液来判断亚硫酸钠固体是否发生变质 | |
| B. | 加入硝酸银溶液看是否产生白色沉淀来判断溶液中是否有氯离子 | |
| C. | 可加入足量的铜粉然后过滤来除去氯化亚铁溶液中的少量氯化铁 | |
| D. | 加入澄清石灰水看是否有白色沉淀来区别碳酸钠溶液和碳酸氢钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 范德华力是普遍存在的一种分子间作用力,属于电性作用 | |
| B. | 范德华力比较弱,但范德华力越强,物质的熔点和沸点越高 | |
| C. | 氢键属于一种较强的分子间作用力,只能存在于分子之间 | |
| D. | 形成氢键时必须含有氢原子,另外氢原子两边的原子必须具有很强的电负性、很小的原子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
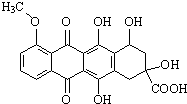
| A. | 属于芳香烃 | |
| B. | 能发生消去反应和酯化反应 | |
| C. | 分子中所有碳原子不可能在同一平面内 | |
| D. | 1mol该有机物与足量NaOH溶液反应,消耗5molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠的电子式: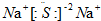 | |
| B. | 氯原子的结构示意图: | |
| C. | 氢氧根离子的电子式: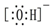 | |
| D. | 质量数为146、中子数为54的铀(U)原子:${\;}_{54}^{146}$U |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com