
| A. | AlCl3过量 | |
| B. | AlCl3的量恰好与氢氧化钠完全反应 | |
| C. | 两种碱均过量 | |
| D. | AlCl3的量恰好与氨水完全反应 |
分析 pH与体积均相同的氢氧化钠溶液和氨水,NH3•H2O在溶液中部分电离,所以c(NH3•H2O)>c(OH-),而c(NaOH)=c(OH-),所以c(NH3•H2O)>c(NaOH),分别与同浓度、同体积的AlCl3溶液反应,生成沉淀的质量也相同;所以NH3•H2O过量,而NaOH恰好与氯化铝反应.
解答 解:pH与体积均相同的氢氧化钠溶液和氨水,NH3•H2O在溶液中部分电离,所以c(NH3•H2O)>c(OH-),而c(NaOH)=c(OH-),所以c(NH3•H2O)>c(NaOH),分别与同浓度、同体积的AlCl3溶液反应,生成沉淀的质量也相同;所以NH3•H2O过量,而NaOH恰好与氯化铝反应;
A.AlCl3不能过量,由于氨水的浓度大,若AlCl3过量,则氨水中生成的氢氧化铝沉淀多,两个溶液中生成的沉淀质量不同,不符合题意,故A错误;
B.NH3•H2O过量,而NaOH恰好与氯化铝反应,则两个溶液中生成的氢氧化铝的物质的量等于氯化铝的物质的量,所以生成沉淀的质量相同,故B正确;
C.两种碱均过量,过量的NaOH会与氢氧化铝反应,沉淀质量减小,而氢氧化铝不与氨水反应,所以生成沉淀质量不同,故C错误;
D.由于氨水的物质的量大于氢氧化钠,AlCl3的量恰好与氨水完全反应,则氨水中生成的沉淀多,所以生成沉淀质量不同,故D错误.
故选B.
点评 本题考查了弱电解质的电离、铝的化合物的性质,题目难度不大,注意把握弱电解质的电离特点以及氢氧化铝的生成,侧重于考查学生的分析能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 当A一定时,K值越小,则元素的非金属性越强 | |
| B. | 当K=0,则该元素系同一周期中最活泼的金属元素 | |
| C. | 当n一定时,随着K值增大,则元素的非金属性逐渐增强 | |
| D. | 当K=l时,则该元素系过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
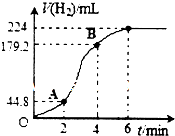 某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:| 实验 序号 | 锌的质量/g | 锌的 状态 | c(H2SO4)/mol•L-1 | V(H2SO4) /mL | 反应前溶液的温度/℃ | 添加剂 |
| 1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 20 | 2滴CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属的密度随着原子序数的递增逐渐减小 | |
| B. | 钾与氧气或水反应比钠与氧气或水反应剧烈,铷、铯的相应反应更剧烈 | |
| C. | 随着原子序数的递增碱金属单质的熔沸点升高 | |
| D. | 碱金属元素阳离子的氧化性随着原子序数的递增依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正价依次升高 | |
| C. | N、O、F原子得电子能力减弱 | |
| D. | Na、K、Rb的电子层数逐渐增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
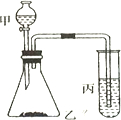 比较硫、碳、硅的非金属性由强到弱的顺序,请从下列给出的试剂中选择合理的实验试剂,利用所给装置验证你的结论(提示:难溶于水).实验试剂:浓盐酸、稀H2SO4、饱和Na2SO3溶液、大理石、Na2CO3粉末、Na2SiO3溶液.实验装置:如图所示
比较硫、碳、硅的非金属性由强到弱的顺序,请从下列给出的试剂中选择合理的实验试剂,利用所给装置验证你的结论(提示:难溶于水).实验试剂:浓盐酸、稀H2SO4、饱和Na2SO3溶液、大理石、Na2CO3粉末、Na2SiO3溶液.实验装置:如图所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠与固态水分别受热熔化 | B. | 氯化铵与苯分别受热变为气体 | ||
| C. | 氯化钠与氯化氢分别溶解在水中 | D. | 碘与干冰分别受热变为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
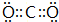 ,
,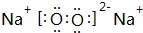
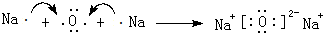 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
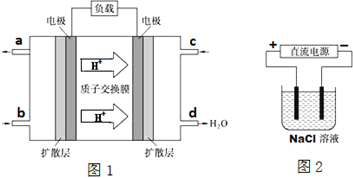
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com