
| A. | 丁醇 | B. | 丁烯 | C. | 一氯戊烷 | D. | 己烷 |
分析 己烷只存在碳链异构,丁烯、一氯戊烷存在碳链异构、位置异构,丁醇存在碳链异构、位置异构、官能团异构,据此解答.
解答 解:A.丁醇的分子式为C4H10O,其同分异构体可能为醇类也可能是醚类,属于醇类的有4种:CH3CH2CH2CH2OH、CH3CH2CH(CH3)OH、(CH3)2CHCH2OH、C(CH3)3OH,属于醚类的有3种:CH3CH2CH2OCH3、CH3CH2OCH2CH3、(CH3)2CHOCH3,共有7种,故A正确;
B.丁烯的分子式为C4H8,其同分异构体可能为烯烃也可能是环烷烃,属于烯烃的有3种:CH2=CHCH2CH3,CH3CH=CHCH3,CH2=C(CH3)2;属于环烷烃有2种:甲基环丙烷,环丁烷,共有5种,故B错误;
C.主链为5个碳原子时:CH3-CH2-CH2-CH2-CH3,此时一氯代物有3种;主链为4个碳原子时: ,此时一氯代物有4种;主链为3个碳原子时:
,此时一氯代物有4种;主链为3个碳原子时: ,此时一氯代物有1种,共有8种,故C错误;
,此时一氯代物有1种,共有8种,故C错误;
D.主链为6个碳原子时:CH3CH2CH2CH2CH2CH3; 主链为5个碳原子时:(CH3)2CHCH2CH2CH3、CH3CH2CH(CH3)CH2CH3;主链为4个碳原子时:(CH3)2CHCH(CH3)2、(CH3)3CCH2CH3 ;共有5种,故D错误,
故选A.
点评 本题主要考查了同分异构体数目的判断,可通过同分异构体的类型进行简单判断,掌握减链法书写同分异构体是解题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 某吸热反应能自发进行,因此该反应一定是熵增反应 | |
| B. | 合成氨的反应达到平衡后,给体系加压(压缩),活化分子百分数增加,所以反应速率加快 | |
| C. | 活化分子之间的碰撞都是有效碰撞,都能引发化学反应 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度 | B. | B物质的相对分子质量 | ||
| C. | 混合气体的压强 | D. | 气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
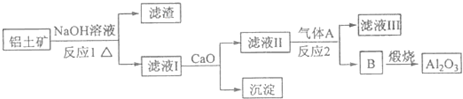

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
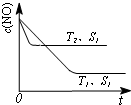 对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题:
对大气污染物SO2、NOx进行研究具有重要环保意义.请回答下列问题: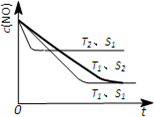 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸 | |
| C. | 酒精灯着火时可用湿布扑灭 | |
| D. | 蒸馏时,温度计水银球应浸没在液体中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{22.4}$ mol/L | B. | $\frac{ab}{22400}$ mol/L | ||
| C. | $\frac{ab}{22400+36.5a}$ mol/L | D. | $\frac{1000ab}{22400+36.5a}$ mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
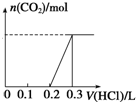 100mL 1mol•L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,
100mL 1mol•L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com