

分析 (1)根据盖斯定律将三个化学方程式进行相加减得到TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g),反应热也相应的相加减计算得到;
(2)根据盖斯定律可以计算化学反应的焓变,进而书写热化学方程式;根据物质的总能量与反应热的关系判断,能量越高物质越稳定;
(3)①铁与稀硫酸反应生成硫酸亚铁和氢气;
②活泼性强的为负极,活泼性弱的为正极,负极被腐蚀.
解答 解:(1)已知:①C(s)+O2(g)═CO2(g);△H=-393.5kJ•mol-1
②2CO(g)+O2(g)═2CO2(g);△H=-566kJ•mol-1
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g);△H=+141kJ•mol-1
根据盖斯定律①×2-②+③得
TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)△H=(-393.5kJ•mol-1)×2-(-566kJ•mol-1)+(+141kJ•mol-1),
即TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)△H=-80kJ/mol,
故答案为:-80kJ/mol;
(2)P4(s,白磷)+5O2(g)=P4O10(s)△H1=-2983.2kJ/mol…①
P(s,红磷)+$\frac{5}{4}$O2(g)=$\frac{1}{4}$P4O10(s)△H2=-738.5kJ/mol,…②
根据盖斯定律:①-②×4可得:P4(s,白磷)=4P(s,红磷)△H=(-2983.2kJ/mol)-(-738.5kJ)×4=-29.2kJ/mol,
说明白磷转化为红磷是放热反应,相同的状况下,红磷能量比白磷低,而能量越低,物质越稳定,故白磷不如红磷稳定,
故答案为:P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol;红磷;低;
(3)①铁与硫酸反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑,离子方程式为:Fe+2H+=Fe2++H2↑;
故答案为:Fe+2H+=Fe2++H2↑;
②B中铁比锡活泼,锡为原电池正极,C中锌为负极,铁为正极,锌被腐蚀;
故答案为:正;锌.
点评 本题考查了热化学方程式的书写、盖斯定律的应用、金属的电化学腐蚀与防护,题目难度不大,注意金属的电化学腐蚀与化学腐蚀的区别以及盖斯定律的含义和应用方法.


科目:高中化学 来源: 题型:选择题
| A. | 1mol铁与足量的氯气完全反应转移的电子数为2NA | |
| B. | 常温常压下,11.2L氯化氢气体中含有的分子数为0.5NA | |
| C. | 标准状况下,1molCO2、CO的混合气中含有的碳原子数为NA | |
| D. | 1L1mol•L-1CuCl2溶液中含有的氯离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加KSCN溶液 | B. | 先加硝酸根,再加硝酸酸化 | ||
| C. | 利用焰色反应 | D. | 先加盐酸酸化,再加氯化钡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
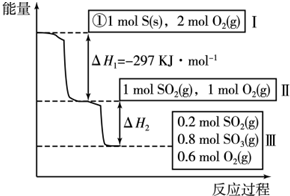 硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.
硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol SO2、1mol O2 | 2mol SO3 | 4mol SO2、2mol O2、 |
| 平衡时n(SO3) | 1.6mol | n2 | n3 |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| SO2或SO3的转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:
二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:| 化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
| E/(kJ.mol-1) | 436 | 343 | 465 | 453 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
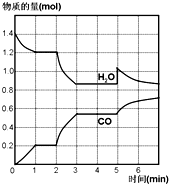 在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)?CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:
在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)?CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Na+、NO3-、SO42- | B. | Mg2+、NH4+、NO3-、SO42- | ||
| C. | NH4+、K+、Cl-、OH- | D. | K+、H+、SO32-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中含有三个碳碳双键 | |
| B. | 乙酸中的官能团是羟基 | |
| C. | 乙醇不能与金属钠反应 | |
| D. | 海水淡化的方法主要有:蒸馏法、电渗析法、离子交换法等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com