
某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图。
材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物。如:
2NH3 + 3CuO 3Cu + N2 +3H2O
 材料2:Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成:Cu2+和Cu:Cu2O + 2H+ == Cu2+ + Cu +H2O
材料2:Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成:Cu2+和Cu:Cu2O + 2H+ == Cu2+ + Cu +H2O
请回答下列问题:
(1)在实验室里,该学习小组设计下列制取纯净干燥氨气的方案,简易、可行的最佳方案是 。
A.加热氯化氨固体,再通过碱石灰
B.在N2和H2的混合气体中加入铁触媒,并加热至500℃,再通过碱石灰
C.加热浓氨水,再通过碱石灰
D.在生石灰中加入浓氨水,再通过浓硫酸
(2)为证明NH3 还原CuO的反应中有水生成,B中应放入的试剂是 。
(3)当观察到 (填现象),即表明A中的反应已经完成。
(4)该小组欲用体积比为1︰4的稀硫酸做试剂,检验反应是否有Cu2O固体生成。现用98%的浓硫酸配制1︰4的稀硫酸,所需的玻璃仪器除了胶头滴管外还有 。
可证明还原产物中含有Cu2O的操作及现象是 。
(5)请写出A中生成Cu2O的化学方程式 。
(6)若用定量的方法测定该反应是否生成Cu2O,最简便且准确的方法是 。
科目:高中化学 来源: 题型:
【化学—选修3 物体结构与性质】(15分)
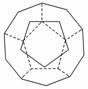 I.德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如右图。
I.德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如右图。
①C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②多面体的顶点数、面数和棱边数的关系,遵循欧拉定理 :,顶点数+面数+棱边数=2,
请回答: C20分子共有________个正五边形,共有________条棱边。
II.A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D元素的核电荷数为29。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为________。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为________,1 mol该分子中含有π键的数目为________。该分子中碳原子的杂化轨道类型是__________________,该分子属于________分子(填“极性”或“非极性”)。
(3)基态D原子的电子排布式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在含CH3COOH和CH3COONa均为0.1mol/L的溶液中,测得pH<7,则下列说法中正确的是
A.c(CH3COO-)<c(Na+) B. c(CH3COOH) + c(CH3COO-)=0.2mol/L
C.c(CH3COOH) > c(CH3COO-) D.c(CH3COO-)>c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
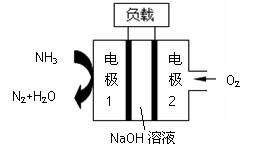
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧
燃料电池示意图如右,有关说法正确的是
A.电池工作时,Na+ 向负极移动
B.通氨气的电极1作电池的正极
C.电子由电极2经外电路流向电极1
D.燃料电池的总反应为:4NH3+3O2=2N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
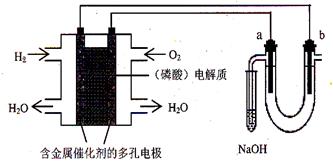
用酸性氢氧燃料电池电解饱和食盐水的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是
A.电池工作时,正极反应式为:O2 +2 H2O + 4e-= 4OH-B.电解时,a 电极周围首先放电的是Cl—
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗0.2g H2 时,b极周围会产生2.24L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法正确的是 ( )。
A.1 mol·L-1 NaCl溶液含有NA个Na+
B.1 mol Cu和足量稀硝酸反应产生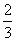 NA个NO分子
NA个NO分子
C.1 L 0.1 mol·L-1氨水含有0.1NA个OH-
D.1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述正确的是 ( )。
A.标准状况下,2.24 L Cl2通入足量NaOH溶液中,反应转移电子的数目为
0.2NA
B.常温下,0.1 mol·L-1 NH4NO3溶液中NO3-数目为0.1NA
C.常温常压下,4.0 g CH4中含有共价键的数目为NA
D.标准状况下,22.4 L CHCl3含有分子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子一定能大量共存的是 ( )。
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.在c(H+)=10-13 mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、I-、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式:_________________________________________。
(2)下列三种情况下,离子方程式与 (1)相同的是________(填序号)。
(1)相同的是________(填序号)。
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
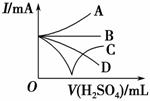 (3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如图中的________(填序号)曲线表示。
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如图中的________(填序号)曲线表示。
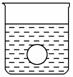 (4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示。向该烧杯中缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将________。
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示。向该烧杯中缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com