
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天
然气(主要成分为CH4)与水进行高温重整制备合成气。
⑴ 已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和
-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。用1 m3(标准状况)的
甲烷与水蒸气在高温下反应制取合成气所需的热量为 (保留整数)。
⑵ 在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得
CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
|

 | 0 | 1 | 2 | 3 | 4 | ||||||
| CH4 | 0.2mol·L-1 | 0.13 mol·L-1 | 0.1 mol·L-1 | 0.1 mol·L-1 | 0.09 mol·L-1 | ||||||
| H2 | 0 mol·L-1 | 0.2 mol·L-1 | 0.3 mol·L-1 | 0.3 mol·L-1 | 0.33 mol·L-1 |
①计算该反应第一次达平衡时的平衡常数K 。
②3min时改变的反应条件是 (只填一种条件的改变即可)。
⑶ 已知温度、压强、投料比X对该反应的影响如图所示。
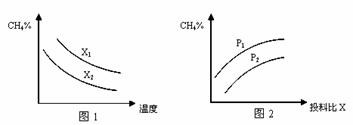
①图1中的两条曲线所示投料比的关系X1 X2(填“=”、“>”或“<”下同)。
②图2中两条曲线所示的压强比的关系:P1 P2。
⑷ 以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为 。
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下
的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A由Al2O3、Fe3O4、Al、Cu中的某几种粉末混合而成,该混合物成分的分析方案如下图所示。
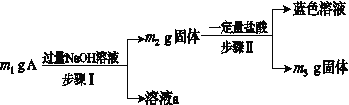
下列分析错误的是( )
A.当m1>m2时,溶液a中的阴离子只有1种
B.生成蓝色溶液的离子方程式为Cu+2Fe3+===Cu2++2Fe2+
C.要确定混合物中是否含有Al,可取A加入适量稀盐酸
D.当m2-m3=2.96 g时,Fe3O4的质量至少为2.32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,充入SO2和18O原子组成的氧气,在一定条件下开始反应,在达到平衡后,18O存在于( )
A.只存在于氧气中 B.只存在于SO3中
C.只存在于SO2和SO3中 D.SO2、SO3、O2中都存在
查看答案和解析>>
科目:高中化学 来源: 题型:
能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化—还原法消除氮氧化物的转化如下: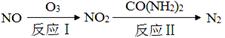
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)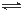 SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)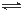 2SO3(g) △H=-196.6 kJ·mol-1,写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) △H=-196.6 kJ·mol-1,写出NO和O2反应生成NO2的热化学方程式 。
某化学兴趣小组构想将NO转化为HNO3,装置如下图一,电极为多孔惰性材料。则负极的电极反应式是 。
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如右图二所示。该反应的ΔH________(填“>”、“<”或“=”)0。
(5)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图三所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图三所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为原子序数依次增大的短周期元素。其形成的小分子化合物Y2X2、Z2X4、X2W2中,分子内各原子最外层电子都满足稳定结构。下列说法正确的是( )
A.X、Y、Z、W的原子半径的大小关系为:W > Y > Z > X
B.在Y2X2、Z2X4、X2W2的一个分子中,所含的共用电子对数相等
C.X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的化合物
D.与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关糖类物质的叙述中正确的是( )
A.糖类是有甜味的物质
B.由碳、氢、氧三种元素组成的有机物属于糖类
C.葡萄糖和果糖互为同系物,蔗糖和麦芽糖互为同系物
D.糖可分为单糖、低聚糖和多糖
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于某病人尿糖检验的做法正确的是( )
A.取尿样,加入新制Cu(OH)2悬浊液,观察发生的现象
B.取尿样,加H2SO4中和碱性,再加入新制Cu(OH)2悬浊液,观察发生的现象
C.取尿样,加入新制Cu(OH)2悬浊液,煮沸,观察发生的现象
D.取尿样,加入Cu(OH)2悬浊液,煮沸,观察发生的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2型分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L; W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径: W>Z>Y>X>M B.XZ2、X2M2、W2Z2均为直线形的共价化合物
C.由X元素形成的单质不一定是导体
D.由 X、Y、Z、M四种元素形成的化合物一定既含有离子键,又含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
1 mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。它在光照的条件下与氯气反应能生成3种不同的一氯取代物。该烃的结构简式是( )

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com