
 依据“溶液中的离子平衡”相关化学知识,回答下列问题.
依据“溶液中的离子平衡”相关化学知识,回答下列问题.分析 (1)NaHCO3是一种是多元弱酸的酸式盐,是强电解质;HCO3$_3^-$水解的离子方程式是HCO3$_3^-$+H2O?H2CO3+OH-;
(2)Ba(OH)2是一种强电解质,完全电离,1molBa(OH)2电离产生2molOH-,所以C(OH-)=C(Ba(OH)2)×2,据此解答,结合水的离子积求水电离出的氢氧根离子的浓度;
(3)据盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,溶液稀释时,醋酸进一步电离,其溶液中离子浓度大于盐酸的离子浓度,故a应为醋酸稀释时的pH值变化曲线;
(4)氯化铝是强酸弱碱盐,其溶液呈酸性,升高温度促进铝离子水解,蒸干时生成氢氧化铝,灼烧时氢氧化铝分解;
(5)先根据酸碱盐分类,再根据酸中酸的强弱分类,盐中盐的水解呈酸碱性分类比较;
(6)根据电荷守恒分析解答,离子浓度的大小是不水解的离子浓度>水解的离子>显性的离子>隐性离子浓度,由此分析解答.
解答 解:(1)NaHCO3是一种是多元弱酸的酸式盐,是强电解质;HCO3$_3^-$水解的离子方程式是HCO3$_3^-$+H2O?H2CO3+OH-,故答案为:强;HCO3$_3^-$+H2O?H2CO3+OH-;
(2)pH=13的Ba(OH)2溶液,C(H+)=10-13mol/L,C(OH-)=$\frac{Kw}{C({H}^{+})}$=10-1mol/L,则C(Ba(OH)2)=0.5×c(OH-)=0.05 mol•L-1,c(H+)水=c(OH-)水=$\frac{1{0}^{-14}}{1{0}^{-13}}$=10-1mol/L,
故答案为:0.05 mol•L-1;10-1mol/L;
(3)据盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,溶液稀释时,醋酸进一步电离,其溶液中离子浓度大于盐酸的离子浓度,故a应为醋酸稀释时的pH值变化曲线,故答案为:a;
(4)氯化铝为强酸弱碱盐,Al3+发生水解,水解的方程式为Al3++3H2O?Al(OH)3+3H+,水解后溶液呈酸性,加热时促进水解,加热过程中,氯化氢挥发促进了铝离子的水解,蒸干溶液得到Al(OH)3,Al(OH)3不稳定,灼烧时分解生成Al2O3,所以白色物质是氧化铝,故答案为:Al2O3;
(5)酸:CH3COOH 是弱电解质,所以只有部分电离,故C(H +)<0.1mol/L,所以PH>1;
碱:⑥NaOH是强电解质,完全电离,C(OH- )=0.1mol/L,所以PH=13;
盐:④NaHSO4是强酸酸式盐,在水中完全电离成钠离子、硫酸根离子、氢离子,所以C(H +)=0.1mol/L,所以PH=1;
⑦NH4Cl是强酸弱碱盐,水解后溶液呈酸性,1<PH值<7;
①KNO3是强酸强碱盐,水溶液呈中性,PH=7;
②Na2CO3 和③NaHCO3都是强碱弱酸盐,水溶液都呈碱性,但碳酸钠的水解程度大于碳酸氢钠 的水解程度,所以碳酸钠溶液的碱性大于碳酸氢钠溶液的碱性.故答案为:⑥>②>③>①>⑦>⑤>④;
(6)醋酸钾溶液根据电荷守恒;c(K+)+c(H+)=c(CH3COO-)+c(OH-);离子浓度大小为:c(K+)>c(CH3COO-)>c(OH-)>c(H+),
故答案为:c(K+)+c(H+);c(CH3COO-)>c(OH-)>c(H+).
点评 本题考查了溶液pH的大小比较和盐的性质,水解的应用,结合电荷守恒分析离子浓度之间的关系,而溶液pH的大小比较,应先对物质进行分类,然后再根据物质能否完全电离、酸和碱的元数等对物质具体分析.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化镁中滴加盐酸:H++OH-═H2O | |
| B. | 碳酸氢钙溶液与稀硝酸反应:Ca(HCO3)2+2H+=Ca2++CO2↑+H2O | |
| C. | 金属铝溶于氢氧化钠溶液:2Al+6OH-═2AlO2-+3H2↑ | |
| D. | 用FeCl3溶液腐蚀铜电路板:2Fe3++Cu═2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者反应的平均速率相等 | B. | 二者溶质的物质的量浓度不相等 | ||
| C. | 二者生成二氧化碳的体积相等 | D. | 二者中氢离子的浓度不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
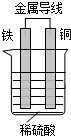 (1)某实验小组为了探究影响化学反应速率的因素,进行了稀硫酸与金属铁反应的对照实验,实验数据如下:
(1)某实验小组为了探究影响化学反应速率的因素,进行了稀硫酸与金属铁反应的对照实验,实验数据如下:| 实验序号 | 金属质量 /g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4) /mL | 反应前溶液温度/℃ | 金属消失的时间/s |
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 50 |
| 3 | 0.10 | 丝 | 1.0 | 50 | 20 | 125 |
| 4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl | |
| B. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| C. | 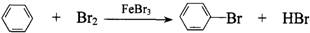 | |
| D. | CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | L层离核比M层离核近 | |
| B. | M层上电子所具有的能量高于L层上的电子 | |
| C. | 当L层上的电子数为奇数时,M层上不可能有电子 | |
| D. | M层上最多可填充8个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com