
科目:高中化学 来源:不详 题型:单选题
| A.浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
| B.在KI-淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应 |
| C.标准状况下,22.4 L任何气体中都含有6.02×1023个分子 |
| D.标准状况下,1 mol H2和O2的混合气体的体积约为22.4 L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
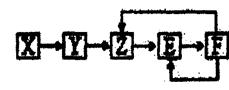
| A.X可能是一种氢化物 |
| B.F中M元素的化合价可能为+5 |
| C.E可能是一种有色气体 |
| D.若X为单质,Y生成Z属于化合反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.05 mol | B.1 mol | C.1.05 mol | D.0.13 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
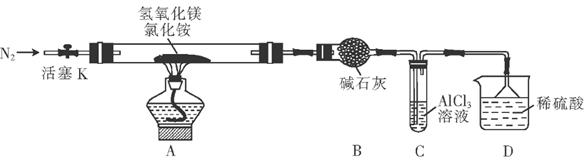
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通常情况下,氮气的性质不活泼是因为氮元素的非金属性很弱的缘故 |
| B.氮气是非极性分子,氨气是极性分子 |
| C.白磷和红磷互为同素异形体,它们之间的相互转化为物理变化 |
| D.五氧化二磷是磷酸的酸酐,二氧化氮是硝酸的酸酐 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.13% | B.23% | C.33% | D.43% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.高温下N2遇空气生成NO2 | B.NO遇空气生成NO2 |
| C.CO2与NO反应生成CO和NO2 | D.NO与H2O反应生成H2和NO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com