
| A. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
分析 A.0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合反应生成碳酸钠溶液,碳酸根离子分步水解溶液显碱性;
B.20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后反应:CH3COONa+HCl=NaCl+CH3COOH,反应后得到溶液中含有CH3COOH,CH3COONa,NaCl,溶液呈酸性,说明氢氧根离子浓度大于氢根离子浓度;
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,一水合氨又电离出氢氧根离子,溶液显碱性;
D.0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合得到醋酸钠溶液,醋酸根离子水解溶液显碱性,溶液中存在质子守恒.
解答 解:A.0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合反应生成碳酸钠溶液,碳酸根离子分步水解溶液显碱性,溶液中离子浓度大小为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),故A错误;
B.20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后反应:CH3COONa+HCl=NaCl+CH3COOH,反应后得到溶液中含有CH3COOH,CH3COONa,NaCl,溶液呈酸性,所得溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故B正确;
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,一水合氨又电离出氢氧根离子,溶液显碱性,c(OH-)>c(H+),结合电荷守恒分析判断,c(Cl-)+c(OH-)=c(NH4+)+c(H+),c(Cl-)<c(NH4+),c(Cl-)+c(H+)<c(NH4+)+c(OH-),故C错误;
D.0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合得到醋酸钠溶液,醋酸根离子水解溶液显碱性,溶液中存在质子守恒c(OH-)=c(H+)+c(CH3COOH),故D错误;
故选B.
点评 本题考查了电解质溶液中离子浓度大小比较、反应后溶液中离子浓度大小、弱电解质电离平衡影响因素、主要是电荷守恒和质子守恒的分析判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
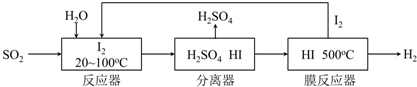
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 8种 | C. | 16种 | D. | 24种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
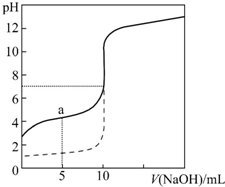 常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入0.1mol•L-1 NaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示.下列说法错误的是( )
常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入0.1mol•L-1 NaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示.下列说法错误的是( )| A. | 图中虚线表示NaOH溶液滴定盐酸时的pH变化 | |
| B. | 酸溶液的体积均为10 mL | |
| C. | a点:c(CH3COO-)>c(CH3COOH) | |
| D. | 当pH=7时,滴定醋酸消耗的V(NaOH)=10 mL,且c(CH3COO-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH、NH3都属于共价化合物 | B. | 12C、C60都属于碳的同素异形体 | ||
| C. | 水玻璃、硅酸都属于胶体 | D. | 生铁、青铜都属于合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeI2与足量的氯气反应转移电子数为2NA | |
| B. | 标准状况下22.4L一氯甲烷和二氯甲烷的混合物中所含氯原子数介于NA至2NA之间 | |
| C. | 0.1molCu与足量热的浓硫酸反应生成的SO2体积标准状况下约为2.24L | |
| D. | 0.2mol/L的Na2S溶液中,所含S2-数目小于0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 诗句 | 相关物质 | 相关说法 |
| A | 春蚕到死丝方尽 | 纤维素 | 高分子化合物 |
| B | 蜡炬成灰泪始干 | 脂肪烃 | 不饱和烃 |
| C | 沧海月明珠有泪 | 碳酸钙 | 强电解质 |
| D | 蓝田日暖玉生烟 | 二氧化硅 | 两性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙干燥氨气 | |
| C. | 用装置丙除去甲烷中混有的乙烯 | |
| D. | 利用装置丁制取硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com