
[s1] 在浓CaCl2溶液中通入氨气和CO2,再经过滤可以制得纳米碳酸钙。
(1)除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是
。
(2)若不通入氨气能否生成CaCO3? 。
(3)若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。
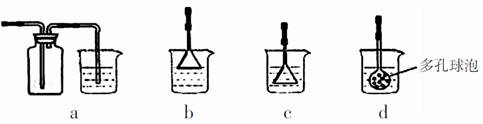
(4)根据上述反应原理,向饱和食盐水中通入氨气和CO2能得到NaHCO3,若食盐水中含有KCl杂质,则检验得到的NaHCO3中是否混有钾盐的方法是 。
[s1]15.
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 编号 | 实验内容 | 实验原理 |
| ① | 制氧气 | H2O2→O2 |
| ② | 制氨气 | NH4Cl→NH3 |
| ③ | 制氯气 | HCl→Cl2 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com