
| A. | SO2+Br2+2H2OH2SO4+2HBr与2HBr+H2SO4(浓) Br2+SO2↑+2H2O互为可逆反应 | |
| B. | 既能向正反应方向进行,又能向逆反应方向进行的反应叫可逆反应 | |
| C. | 在同一条件下,同时向正、逆两个方向进行的反应叫可逆反应 | |
| D. | 在一定条件下,SO2被氧化成SO3的反应是可逆反应 |
分析 可逆反应是指在同一条件下,既能向生成物方向进行,同时又能向反应物方向进行的反应.根据可逆反应的特点进行判断.
解答 解:A.两个反应的硫酸的浓度不同,故不能互为可逆反应,故A错误;
B.可逆反应是指在同一条件下,既能向生成物方向进行,同时又能向反应物方向进行的反应,故B错误;
C.可逆反应是指在同一条件下,既能向生成物方向进行,同时又能向反应物方向进行的反应,故C正确;
D.2SO2+O2$\stackrel{催化剂}{?}$2SO3,正逆反应条件相同,故为可逆反应,故D正确.
故选CD.
点评 本题考查可逆反应的定义难度不大.要注意可逆反应的特点:同一条件下、正逆反应同时进行.


科目:高中化学 来源: 题型:解答题
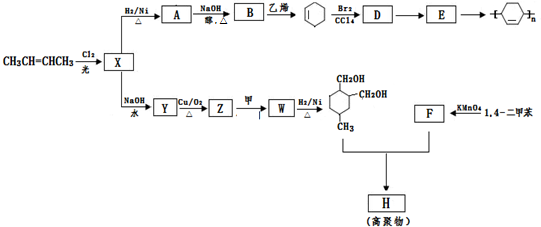
 (或写成
(或写成 R代表取代基或氢)
R代表取代基或氢)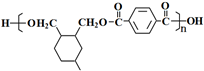 .
. ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成,它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.
已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成,它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如图1所示,为六方最密堆积(填堆积方式).
,其原子核外共有22种运动状态不相同的电子.金属钛晶胞如图1所示,为六方最密堆积(填堆积方式).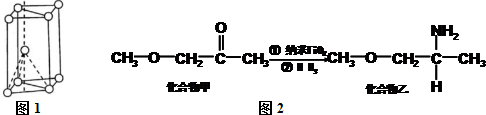
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有③ | B. | ②③ | C. | ③⑤ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应的化学反应速率是指正反应速率 | |
| B. | 在可逆反应里正反应的速率是正值,逆反应的速率是负值 | |
| C. | 在一定条件下,当可逆反应的正反应速率与逆反应速率相等时,反应物和生成物的浓度不再发生变化,这就是该反应所达到的限度 | |
| D. | 对于可逆反应来说,反应物转化为生成物没有一定的限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com