
【题目】室温下,下来事实不能说明NH3·H2O为弱电解质的是
A. 0.1 mol·L-1NH3·H2O的pH小于13
B. 0.1 mol·L-1 NH4Cl溶液的pH小于7
C. 相同条件下,浓度均为0.1 mol·L-1 NaOH溶液和氨水,氨水的导电能力弱
D. 0.1 mol·L-1NH3·H2O能使无色酚酞试液变红色
【答案】D
【解析】A项,室温下0.1 mol·L-1氨水溶液pH<13,溶液中c(OH-)<![]() mol·L-1=0.1mol/L<c(NH3·H2O),说明NH3·H2O部分电离,为弱电解质,A正确;B项,室温下0.1 mol·L-1NH4Cl溶液的pH小于7,说明氯化铵是强酸弱碱盐,则证明NH3·H2O是弱电解质,B正确;C项,相同条件下,浓度均为0.1 mol·L-1NaOH溶液和氨水,氨水的导电能力弱,说明氨水没有完全电离,则证明NH3·H2O是弱电解质,C正确;D项,0.1 mol·L-1NH3·H2O能使无色酚酞溶液变红色,说明NH3·H2O显碱性,电离产生OH-,不能证明是弱电解质,D错误。
mol·L-1=0.1mol/L<c(NH3·H2O),说明NH3·H2O部分电离,为弱电解质,A正确;B项,室温下0.1 mol·L-1NH4Cl溶液的pH小于7,说明氯化铵是强酸弱碱盐,则证明NH3·H2O是弱电解质,B正确;C项,相同条件下,浓度均为0.1 mol·L-1NaOH溶液和氨水,氨水的导电能力弱,说明氨水没有完全电离,则证明NH3·H2O是弱电解质,C正确;D项,0.1 mol·L-1NH3·H2O能使无色酚酞溶液变红色,说明NH3·H2O显碱性,电离产生OH-,不能证明是弱电解质,D错误。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】丁苯酞是一种治疗脑血管疾病的常用药,它可以用烃A 为原料按以下路线合成:
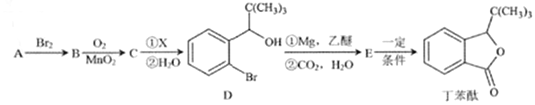
已知:I.A的质谱如下图所示;

II.C能发生银镜反应
III. 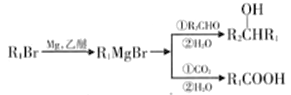
回答以下问题:
(1)A的名称是______________;丁苯酞所含官能团的名称是________________________。
(2)A→B的反应类型是________________;A→B的反应条件是___________________________。
(3)C的结构简式为________________________。
(4)E![]() 丁苯酞的反应方程式为_________________________。
丁苯酞的反应方程式为_________________________。
(5)芳香族化合物H与E所含官能团的种类和数目相同,H比E的相对分子质量小56.1mol H分别与NaOH溶液和NaHCO3溶液反应,消耗NaOH和NaHCO3的物质的量之比为2:1,则符合条件的H的结构有_____种;其中在核磁共振氡谱图中有5组吸收峰,峰面积之比为1:1:2:2:2的结构简式为_________________。
(6)参照题目信息,写出以![]() 为原料,制备
为原料,制备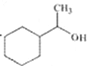 的合成路线(无机试剂及2个碳原子以内的有机试剂任选):____________________________________。
的合成路线(无机试剂及2个碳原子以内的有机试剂任选):____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:
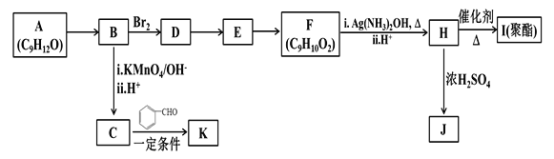
已知以下信息:
①A是芳香族化合物且分子侧链上有处于两种不同环境下的氢原子;
②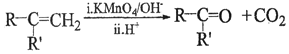
③RCOCH3+RCHO![]() RCOCH=CHR
RCOCH=CHR
回答下列问题:
(1)A生成B的反应类型为________,由D生成E的反应条件为________。
(2)H 的官能团名称为________。
(3)I的结构简式为_______。
(4)由E生成F的反应方程式为________ 。
(5)F有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式为_______。
①能发生水解反应和银镜反应;②属于芳香族化合物且分子中只有一个甲基;
③具有5个核磁共振氢谱峰
(6)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
)为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是大气的主要污染物,是当前环保工作的重要研究内容之一。
(1)氨气还原氮的氧化物
①N2(g)+O2(g)=2NO(g) △H1 ②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=________。(用含△H1、△H2的式子表示)
依据反应②,可将氨气直接用于燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:____________。
(2)在一密闭容器中投入一定量的氨气,发生反应2NH3![]() N2+3H2△H>0,反应过程中NH3的浓度随时间变化的情况如图所示。
N2+3H2△H>0,反应过程中NH3的浓度随时间变化的情况如图所示。
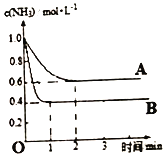
请回答:
①曲线A中,反应在前2min内氢气的平均反应速率为________。此条件下的平衡常数K=____。
②在其它条件相同时,若改变某一条件,使该反应发生如图曲线B的反应情况,则此条件可能是改变_________(填“浓度”、“压强”、“温度”或“催化剂”)。简述判断理由_________。
(3)一定温度下,在恒压密闭容器中N2O5可发生下列反应:
①2N2O5(g)![]() 4NO2(g)+O2(g) ②2NO2(g)
4NO2(g)+O2(g) ②2NO2(g)![]() 2NO(g)+O2(g)
2NO(g)+O2(g)
若达平衡时,c(NO2)=0.6mol/L,c(O2)=1.2mol/L,则反应②中NO2的转化率为______,N2O5(g)的起始浓度应至少大于______mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碱的作用下,两分子酯缩合形成β-羰基酯,同时失去一分子醇,该反应称克菜森(R·L·Claisen)酯缩合反应,其反应机理如下:
2RCH2COOC2H5 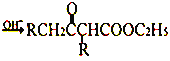 +C2H5OH 利用Claisen反应制备化合物I的一种合成路线如下:
+C2H5OH 利用Claisen反应制备化合物I的一种合成路线如下:
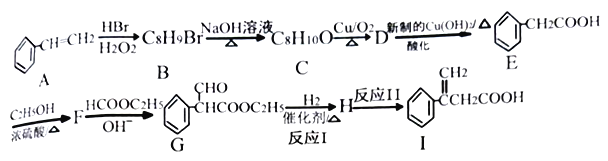
回答下列问题:
(1)E的名称为_______,F的结构简式为_______。
(2)I中官能团的名称是_______,反应I的反应类型是_______。
(3)F→G反应的化学方程式为_______。
(4)满足下列条件E的同分异构体有_____种。
①含有苯环,能发生水解反应 ②分子结构中含有一个甲基
其中分子结构中只有一个侧链的有机物结构简式为______、_______。
(5)乙酰乙酸乙酯(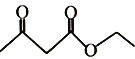 )是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线________(无机试剂任选)。
)是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 一定条件下反应N2+3H2![]() 2NH3,达到平衡时,3v正(H2)=2v正(NH3)
2NH3,达到平衡时,3v正(H2)=2v正(NH3)
B. 10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能降低反应速率,又不影响H2的生成
C. 将pH=a+1的氨水稀释为pH=a的过程中,c(OH-)/c(NH3H2O)变小
D. 25℃时,0.1 mol/L的NaHB溶液呈酸性,说明H2B为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。某种手机电路板中含有以下金属:Sn、Pb、Fe、Cu、Au、Ag、Ni(镍,银白色)、Pd (钯,银白色)。如图是某工厂回收其中部分金属的流程图.(假设流程图中各反应均恰好完全反应.己知:2Cu+O2+2H2SO4![]() 2CuSO4+2H2O)
2CuSO4+2H2O)

(1)步骤②中产生的气体是________(写化学式)。
(2)滤渣2中含有的金属是________
(3)步骤⑤反应的化学方程式________。
(4)步骤⑥回收的纯净物B是________ (写化学式).
(5) 金属Fe、Ni、Pd在溶液中的活动性由强到弱的顺序依次是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A. 23gNa变为Na+时失去的电子数为0.2NA B. 18g水所含的电子数为NA
C. 8g He所含的分子数为NA D. 16g O2与16g O3所含的原子数均是NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和H2O。已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,CH4和SO2反应的热化学方程式为________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
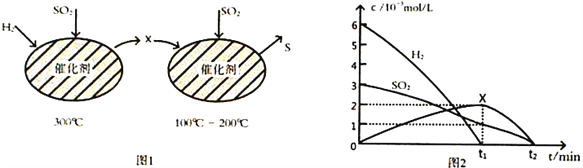
①分析可知X为____________(写化学式),0~t1时间段的温度为_________________,0~t1时间段用SO2 表示的化学反应速率为________________________________。
②总反应的化学方程式为_______________________________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
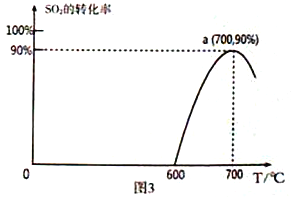
①该反应的ΔH_______________0 (填“>”或“<”)。
②计算a点的平衡常数为_______________________。
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为__________________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com