
中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用题图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
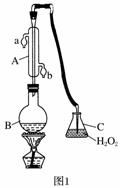
(1)仪器A的名称是______________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为________________________________。
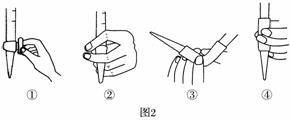
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择题图2中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施________________________________________________________________________
________________________________________________________________________。
答案 (1)冷凝管(或冷凝器) b
(2)SO2+H2O2===H2SO4
(3)③ 酚酞 ④ (4)0.24
(5)原因:盐酸的挥发;改进措施:用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响
解析 (1)A仪器的名称为冷凝管或冷凝器;为使冷却效果好,应将冷却水从处于低处的b口通入。
(2)SO2具有强还原性,H2O2具有强氧化性,二者发生氧化还原反应:SO2+H2O2===H2SO4。
(3)NaOH盛装在碱式滴定管中,应将橡皮管向上弯曲排出气泡,故选③。滴定至终点时溶液的pH=8.8,在酚酞的变色范围内,故可选用酚酞作指示剂。液面在10 mL时滴定管中有刻度的液体为40 mL,因滴定管的下端有一段无刻度,故管内液体的体积大于40 mL。
(4)SO2与NaOH存在如下关系:
SO2 ~ H2SO4 ~ 2NaOH
64 g 2 mol
m(SO2) 0.090 0 mol·L-1×0.025 L
解得:m(SO2)=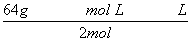 =0.072 g,故葡萄酒中SO2的含量为
=0.072 g,故葡萄酒中SO2的含量为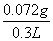 =0.24 g·L-1。
=0.24 g·L-1。
(5)盐酸为挥发性酸,挥发出的HCl消耗NaOH,使测量值偏大。可以用难挥发的稀硫酸代替盐酸进行该实验。


科目:高中化学 来源: 题型:
已知烯烃、炔烃在臭氧的作用下发生以下反应:
CH3—CH===CH—CH2—CH===CH2→CH3CHO+OHC—CH2—CHO+HCHO
CH3—C≡C—CH2—C≡CH―→CH3COOH+HOOCCH2COOH+HCOOH 某烃分子式为C10H10,在臭氧作用下发生反应:C10H10→CH3COOH+3HOOC—CHO+CH3CHO,下列判断正确在是:( )
A.其结构中含有4个碳碳双键,4个碳碳三键
B.分子中含有4个碳碳双键和2个碳碳三键
C.该烃结构简式是:CH3-C≡C-CH=CH-C≡C-CH=CH-CH3
D. 其结构中含有2个碳碳双键,4个碳碳三键
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:C(s,金刚石)=C(s,石墨)△H=-1.9KJ/mol
C(s,金刚石)+O2(g)=CO2(g) △H1
C(s,石墨)+O2(g)=CO2(g) △H2
根据上述反应所得出的结论正确的是
A.△H1=△H2 B.△H1>△H2
C.△H1<△H2 D.金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.增大反应物浓度,可增大单位体积内活化分子的数目,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂影响反应活化能,能增大单位体积内活化分子的百分比,从而增大反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。回答下列问题:
①平衡时CO的转化率为 ,该反应的化学平衡常数为 。
②如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将 (填“增大”、“减小”、“不变”),预计CO的转化率为 。
③427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H 0(填“>”、“==”、“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一份CuO和Cu2O的混合物,用H2还原法测定其中的CuO质量x g,实验中可以测定以下数据:①W:混合物的质量(g)、②W(H2O):生成水的质量(g)、③W(Cu):生成 Cu的质量(g)、④V(H2):标准状况下消耗H2的体积(L)。
(已知摩尔质量:Cu:64 g·mol-1、CuO:80 g·mol-1、Cu2O:144 g·mol-1、H2O:18 g·mol-1)
(1)为了计算x至少需要测定上述4个数据中的____个,这几个数据的组合共有________种。请将这些组合一一填入下列空格中。
说明:①选用W、W(H2O)、W(Cu)、V(H2)表示,不必列出具体算式。
②每个空格中填一种组合,有几种组合就填几种,不必填满。
(2)从上述组合中选出一个含W数据的求x的计算式:
________________________________________________。
(3)以上数据组合中易于取得的一组是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下表信息,判断以下叙述正确的是 ( )
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.102 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.R与T形成的化合物RT3中,各原子均满足8电子的稳定结构
B.单质与稀盐酸反应产生氢气的剧烈程度为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
关于基态氢原子的电子云图,下列说法正确的是( )
A.一个小黑点代表一个电子
B.小黑点表示电子曾经出现过的位置
C.小黑点的疏密表示电子在核外空间某处单位体积内出现机会的多少
D.基态氢原子的电子云是圆形的
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物与生产、生活密切相关。下列说法不正确的是
A.天然气的主要成分是甲烷 B.棉花的主要成分是淀粉
C.酒精类饮料中含有乙醇 D.牛奶中含有蛋白质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com