
【题目】下列各组元素中,按最高正化合价递增顺序排列的是( )
A.C、N、FB.Na、Mg、AlC.F、Cl、BrD.Cl、S、P
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】将50g溶质质量分数为w1,物质的量浓度为c1的浓硫酸沿玻璃棒加入到Vml水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀溶液.下列说法中正确的是( )
A. 若w1=2w2,则c1<2c2,V=50 mL
B. 若w1=2w2,则c1>2c2,V<50 mL
C. 若c1=2c2,则w1<2w2,V<50 mL
D. 若c1=2c2,则w1<2w2,V>50 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3.01×1023个CO2分子中含______mol氧原子,在标准状况下其体积为______L,它与______gH2O含有相同的氧原子数。
(2)同温同压下,等质量的N2和CO2所含分子数比为______,体积比为______。
(3)某气体在标准状况下的密度为1.25gL-1,则28g该气体所含有的分子数为______。
(4)在标准状况下,22.4L由氮气和氧气组成的混合气体,其质量为30g,则其中氧气的质量为___g。
(5)同温同压下,同体积的H2和A气体的质量分别为1.0g和16.0g,则A的相对分子质量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中氮氧化物成为人们关注的主要问题之一。
Ⅰ.利用NH3的还原性可以消除氮氧化物的污染。
(1)请写出NH3的电子式________________。
(2)已知:①H2O(l)=H2O(g) △H1=+44.0kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H2=+229.3 kJ·mol-1
③4NH3(g)+5O2(g)= 4NO(g)+6H2O(g)△H3=-906.5kJ·mol-1
则反应④4NH3(g)+6NO(g)= 5N2(g)+6H2O(l)的△H=_______;该反应的平衡常数K的表达式为__________;增加压强,该反应中NO的转化率将____________ (填“提高”、“不变”或“降低”)。
(3)一定温度下,在容积固定的密闭容器中,发生反应④,下列能判断该反应达到平衡的是____________ (填标号)
A.c(NH3)=c(N2) B.容器中压强不变
C.容器中混合气体的密度不变 D.1molN-H键断裂的同时,生成1molO-H键
(4)某小组研究了NH3和NO在Ag2O催化剂表面发生上述反应④,其中NO在一定时间内的转化率随温度变化的结果如右图所示。在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是____________。在温度为420~580K时,有氧条件下NO生成N2的转化率明显高于无氧条件的原因可能是____________。
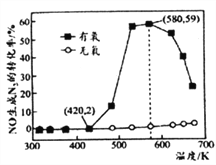
Ⅱ.用尿素[(NH2)2CO]水溶液吸收氮氧化物也是一种可行的方法。NO和NO2不同配比混合气通入尿素溶液中,总氨还原率与配比关系如右图。
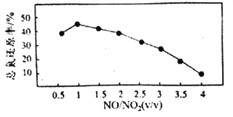
(5)用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,将N元素转变为对环境无害的气体写出该反应的化学方程式____________。
(6)随着NO和NO2配比的提高,总氮还原率降低的主要原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VL 浓度为1mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是
A.通入标准状况下的HC1气体22.4VL
B.将溶液加热浓缩到0.5VL
C.加入10mol·L-1的盐酸0.2VL,再稀释至1.5VL
D.加入VL3mol·L-1的盐酸混合均匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于加成反应的是( )
A.乙烯通入酸性高锰酸钾溶液中
B.乙烯通入溴水中
C.苯与液溴在FeBr3催化下反应
D.甲烷与氯气在一定条件下反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.热水瓶胆中的水垢可以用食醋除去
B.可以用淀粉溶液检验加碘盐中是否含碘元素
C.在蔗糖中加入浓硫酸出现黑色物质, 说明浓硫酸具有脱水性
D.做红烧鱼时,常加一些食醋和酒会更香,是因为生成少量的酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为实验室某浓盐酸试剂瓶上的有关数据,该浓盐酸中HCl的物质的量浓度为________mol/L。某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.3 mol/L稀盐酸:

(2)该学生需要量取_______mL上述浓盐酸进行配制。
(3)配制过程中,除需要使用烧杯、量筒、玻璃棒外,还需要使用的仪器是(填写名称)_______、_______。
(4)配制时,其正确的操作顺序是(要求用字母表示,每个字母只能用一次)_____________________;
A.用30mL蒸馏水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量蒸馏水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加蒸馏水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加蒸馏水,直到液面接近刻线1~2cm处
(5)在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是_____________________
A.摇匀后静置,发现液面低于刻度线,继续加水至与刻度线相切
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配制前用已知浓度的稀盐酸润洗容量瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com