
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元
素的含量。实验步骤如下:
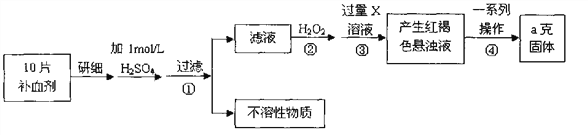
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法________________________________,该
过程的现象为:______________________________
(2)步骤②加入过量H2O2的目的(用离子方程式表示):_______________。
(3)步骤③中反应的离子方程式:_______________________________________。
(4)实际上向滤液中直接滴加X溶液最终也会生成红褐色浊液,此过程中发生的
氧化还原反应为(用化学方程式表达)_________________________。
(5)步骤④中最终得到a克红棕色粉末,则一系列处理的操作步骤:_________、
洗涤、_________、冷却、称量。
(6)若实验无损耗,则每片补血剂含铁元素的质量__________g。
(7)正常人每天应补充14mg左右的铁,如果全部通过服用含FeSO4·7H2O的片剂
来补充铁,则正常人每天服需用含______________mgFeSO4·7H2O的片剂。
【答案】 先滴加KSCN溶液,再滴加新制氯水(或双氧水、稀硝酸等合理氧化剂) 现象:先无明显变化,滴加新制氯水后溶液变为血红色 2Fe2++H2O2+2H+=2Fe3++2H2O Fe3++3OH—==Fe(OH)3↓(或Fe3++3NH3·H2O==Fe(OH)3↓+3NH4+) 4Fe(OH)2+O2+2H2O===4Fe(OH)3 过滤 灼烧 0.07a 69.5mg
【解析】(1)检验Fe2+,先加KSCN溶液,溶液不变红,再加新制氯水或H2O2,溶液变红,说明含有溶液中含有Fe2+;现象是开始不变红,滴加氧化剂溶液后,溶液变为血红色;(2)加入H2O2的目的是把Fe2+氧化成Fe3+,即2Fe2++H2O2+2H+=2Fe3++2H2O;(3)③中加入X后出现红褐色沉淀,此沉淀是Fe(OH)3,X为碱,因此反应式为:Fe3++3OH-==Fe(OH)3↓(或Fe3++3NH3·H2O==Fe(OH)3↓+3NH4+);(4)Fe2+和碱中OH-反应生成Fe(OH)2,Fe(OH)2容易被氧气氧化成Fe(OH)3,发生4Fe(OH)2+O2+2H2O===4Fe(OH)3;(5)2Fe(OH)3![]() Fe2O3+3H2O,因此步骤为过滤、洗涤、灼烧、冷却、称量;(6)根据铁元素守恒,铁元素的质量为2a×56/(160×10)g=0.07ag;(7)根据铁元素守恒,14×278/56mg=69.5mg。
Fe2O3+3H2O,因此步骤为过滤、洗涤、灼烧、冷却、称量;(6)根据铁元素守恒,铁元素的质量为2a×56/(160×10)g=0.07ag;(7)根据铁元素守恒,14×278/56mg=69.5mg。


科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应:N2(g)+3H2(g)![]() 2NH3(g),△H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是 ( )
2NH3(g),△H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是 ( )
A.加催化剂υ(正)、υ(逆)都发生变化且变化的倍数相等
B.加压,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数
C.降温,υ(正)、υ(逆)都减小,且υ(正)减小倍数小于υ(逆)减小倍数
D.加入氩气,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取50mL的Na2CO3和Na2SO4 的混合溶液,加入适量Ba(OH)2溶液50mL后,恰好完全反应,过滤得到滤液和12.54g白色沉淀(干燥后),再用足量的稀硝酸处理沉淀,最后沉淀减少到4.66g,并有气体放出。
(1)4.66g白色沉淀是_________(填化学式),写出12.54g白色沉淀加入稀硝酸后变为4.66g所发生反应的离子方程式___________________________;
(2)产生的气体在标准状况下的体积为__________ml;
(3)原混合液中Na2SO4的物质的量浓度______;
(4)计算过滤出12.54g沉淀后,所得滤液中溶质的物质的量浓度(忽略混合溶液体积的变化)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应mA(g)+nB(g)==pC(g),达到平衡后保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )[来源
A.m+n>p B.平衡向逆反应方向移动
C.A的转化率提高 D.C的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒沙特列原理解释的是 ( )
A.用排饱和食盐水的方法收集氯气
B.在沸腾的蒸馏水中滴加FeCl3溶液,制Fe(OH)3胶体
C.在FeCl3溶液中加AgNO3溶液,产生白色沉淀
D.向AgCl 和水的悬浊液中加入足量的Na2S溶液并振荡,白色固体转化为黑色固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在花瓶中插上一束美丽的鲜花,将会给你紧张而又忙碌的学习、生活带来轻松和愉悦的心情。可是过不了几天,花儿就会枯萎。如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命。下表是1L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成 分 | 质 量(g) | 摩尔质量(g/mol) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是_________(填字母)。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中的K+的物质的量浓度约为(阿司匹林中不含K+)_______
(3)配制上述1L“鲜花保鲜剂”所需的仪器有:量筒、烧杯、玻璃棒、托盘天平、药匙、___________________。(填所缺仪器的名称)。
(4)在溶液配制过程中,下列操作对配制结果没有影响的是______(填字母)。
A.定容用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)实验室用固体加热制氨气的化学反应方程式为:
__________________________________________________________
(6)若将收集到的氨气溶于水配成100 mL的溶液,所得氨水中NH3物质量浓度(不考虑NH3与H2O的反应)为0.3 mol·L-1,则需要氨气的体积为________mL(标
准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。W的单质与H2在暗处能化合并发生爆炸,X是同周期中金属性最强的元素,Y原子的最外层电子数等于电子层数,W和Z原子的最外层电子数相同。下列说法错误的是( )
A. 单质的沸点:Z>W
B. 简单离子半径:X>W
C. 元素X与氧可形成既含离子键也含非极性共价键的化合物
D. X、Y、Z的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com