
科目:高中化学 来源: 题型:阅读理解
| NO | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块铜片,再用滴管滴入10mL稀硝酸.据此回答下列问题:
如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块铜片,再用滴管滴入10mL稀硝酸.据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

请根据表回答下列问题:
(1)硒的熔点范围可能是_____________。
(2)碲的化合价可能有_____________。
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱顺序是_____________(填化学式)。
(4)氢硒酸有较强的(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为____________________________________。
(5)下图所示为氧族元素单质与H2反应过程中的能量变化(ΔH)示意图,其中a、b、c、d分别表示氧族中某一元素的单质,ΔH为相同物质的量的单质与H2反应的反应热。则:b代表___________(写单质名称)。
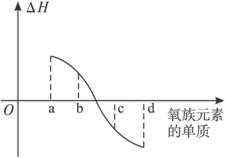
(6)硫的最高价含氧酸(H2SO4)是一种用途广泛的化学试剂。工业大量生产时通常要经过①含硫物质的氧化 ②SO2催化氧化成SO3 ③SO3的吸收三个主要过程。已知SO2的催化氧化是一个放热的可逆反应,该反应化学平衡常数(K)的表达式为_______________________,为提高SO2的转化率,试写出两种可以采用的措施:_____________________________;_______________________________。吸收SO3时若反应过快会形成酸雾,则是否可以用水直接吸收?________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
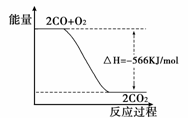
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/mol
根据以上热化学方程式判断,下列说法错误的是
A.CO2气体分解生成CO气和O2气体的反应是放热反应
B.CO气体与O2气体生成CO2气体的反应是放热反应
C.右图可表示由CO气体生成CO2气体的反应过 程和能量关系
D.在相同条件下,2 mol CO气体与1 mol O2气体的能量总和大于2 mol CO2气体的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com