
| A. | 生铁比纯铁容易生锈 | |
| B. | 钢铁的腐蚀生成疏松氧化膜,不能保护内层金属 | |
| C. | 钢铁发生吸氧腐蚀时,正极反应式为:O2+2H2O+4e→4OH- | |
| D. | 为保护地下钢管不受腐蚀,可使其与直流电源正极相连 |
分析 A.作原电池负极的金属加速被腐蚀;
B.钢铁和空气、水能构成原电池导致钢铁被腐蚀,生成疏松的氧化铁;
C.钢铁发生吸氧腐蚀时,正极上氧气得电子发生还原反应;
D.作电解池阳极的金属加速被腐蚀,作阴极的金属被保护.
解答 解:A.生铁中含有C、Fe,生铁和电解质溶液构成原电池,Fe作负极而加速被腐蚀,纯铁不易构成原电池,所以生铁比纯铁易生锈,故A正确;
B.钢铁和空气、水能构成原电池导致钢铁被腐蚀,钢铁的腐蚀生成疏松氧化膜不能隔绝空气,所以不能保护内层金属,故B正确;
C.钢铁发生吸氧腐蚀时,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-═4OH-,故C正确;
D.作电解池阳极的金属加速被腐蚀,作阴极的金属被保护,为保护地下钢管不受腐蚀,可使其与直流电源负极相连,故D错误;
故选D.
点评 本题考查金属腐蚀与防护,明确原电池和电解池原理即可解答,知道钢铁发生析氢腐蚀、吸氧腐蚀发生的电极反应,知道如何采用化学方法保护金属,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
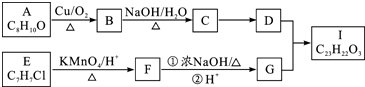
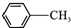 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$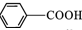

 .
.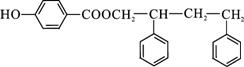 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的氧化剂只有CuSO4 | |
| B. | SO42-既不是氧化产物也不是还原产物 | |
| C. | 1mol CuS04 还原了$\frac{1}{4}$mol S | |
| D. | 被还原的S和被氧化的S的质量比为7:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸的物质的量浓度为9.2 mol/L | |
| B. | 1 mol Zn与足量该硫酸反应产生2 g氢气 | |
| C. | 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白磷、硅 | B. | 碳化硅、硫酸钠 | C. | 水晶、金刚石 | D. | 碘、汞 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
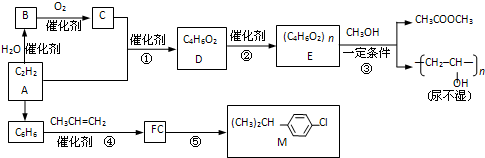
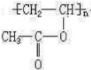 .
.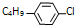 ,则R有4种.
,则R有4种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
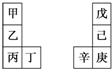 甲~辛等元素在周期表中的相对位置如表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A. | 丙与庚的原子序数相差3 | |
| B. | 气态氢化物的热稳定性:戊>己>庚 | |
| C. | 乙所在周期元素中,其简单离子的半径最大 | |
| D. | 乙的单质在空气中燃烧生成的化合物只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
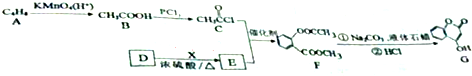
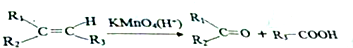
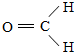 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中一定有K+、Br-、CO32-、AlO2- | |
| B. | 溶液中一定没有Mg2+、Cu2+、Cl-、NH4+ | |
| C. | 不能确定溶液中是否有K+、SO42-、Cl- | |
| D. | 往第3份溶液中滴加BaCl2可确认是否有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com