
| A. | B的单质在自然界只有一种核素 | |
| B. | 元素C、D、E的简单离子的半径依次减小 | |
| C. | E的单质氧化性最强 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
分析 A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素C在同周期的主族元素中原子半径最大,则C为Na元素;元素D是地壳中含量最多的金属元素,则D为Al元素;元素B的原子最外层电子数是其电子层数的2倍,B有2个电子层,最外层电子数为4,故B为C元素;其中元素A、E的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素,E的原子序数等于铝元素,E为Cl元素,以此解答该题.
解答 解:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素C在同周期的主族元素中原子半径最大,则C为Na元素;元素D是地壳中含量最多的金属元素,则D为Al元素;元素B的原子最外层电子数是其电子层数的2倍,B有2个电子层,最外层电子数为4,故B为C元素;其中元素A、E的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素,E的原子序数等于铝元素,E为Cl元素.
A.B为C元素,在自然界存在多种同位素,如12C、13C等,故A错误;
B.元素C、D、E的简单离子中C、D有两个电子层,C有3个电子层,C的离子的半径最大,故B错误;
C.E为Cl元素,单质具有强氧化性,故C正确;
D.化合物AE与CE化学键类型分别为共价键、离子键,故D错误.
故选C.
点评 本题主要考查的原子结构与元素周期律的应用,为高频考点,题目考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力,难度中等.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:解答题
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 8:1 | B. | 2:1 | C. | 3:2 | D. | 2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$
OH+NaBr+H2SO4$\stackrel{75-80℃}{→}$ Br+NaHSO4+H2O,则制备溴代环戊烷的装置可以选择( )
Br+NaHSO4+H2O,则制备溴代环戊烷的装置可以选择( )| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组分 | CO | CO2 | H2 |
| 体积分数 | 20% | 5% | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol/L Na2C2O4中:2c(Na+)═c(C2O42- )+c(HC2O4-)+c(H2C2O4) | |
| B. | 浓度均为0.1mol/L的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)═2c(CO32-)+c(OH-)+c〔HCO3-) | |
| C. | 向10mL pH=l2的NaOH溶液中滴加等体积pH=2的CH3COOH:c(CH3COO-)>c(Na+)>c(OH-)>C(H+) | |
| D. | 0.2mol/L NaHCO3与0.1mol/L KOH溶液等体积混合:c(Na+)═2c(CO32-)+c〔HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,正极反应式为Cn[AlCl4]+e-═[AlCl4]-+Cn | |
| B. | 充电时,阴极反应式为4[Al2Cl7]-3e-═Al+7[AlCl4]- | |
| C. | 放电过程中,负极每消耗1mol Al,导线中转移的电子数为3NA(NA为阿伏伽德罗常数的值) | |
| D. | 充、放电过程中,R+的移动方向相反 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
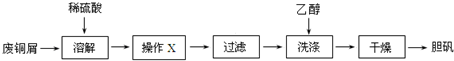
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2 | B. | MgCl2 | C. | BF3 | D. | PCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com