
分析 (1)工业合成氨是氮气和氢气在催化剂高温高压的条件合成氨气;
(2)玻璃塞中含有二氧化硅,利用二氧化硅与碱反应来分析;
(3)四氧化三铁与铝反应生成铁和氧化铝;
(4)①该反应中P元素的化合价升高;
②由转移电子计算X中Cl元素的化合价,确定还原产物.
解答 解:(1)在高温高压催化剂的条件下,氮气和氢气反应生成氨气,化学方程式为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,故答案为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;
(2)因玻璃塞中的二氧化硅与氢氧化钠反应生成硅酸钠,具有粘合性,使试剂瓶在下次使用时不能打开,其离子反应为SiO2+2OH-═SiO32-+H2O,
故答案为:SiO2+2OH-═SiO32-+H2O;
(3)四氧化三铁与铝反应生成铁和氧化铝,化学方程式为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe;
故答案为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe;
(4)①该反应中P元素的化合价由-3价升高为+5价,则PH3为还原剂,故答案为:PH3;
②设还原产物X中Cl元素的化合价为x,由电子转移可知,0.2mol×(5-x)=1mol,解得x=0,则还原产物X为Cl2,故答案为:Cl2.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,注意把握元素化合价的判断和规律性知识的应用,从化合价变化的角度分析,注意把握物质的性质以及离子方程式的书写,题目难度中等.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 处理氯气实验中的尾气:OH-+Cl2═ClO-+Cl-+H2O | |
| B. | 硫酸铜与氢氧化钡溶液混合产生沉淀:Ba2++SO42-═BaSO4↓ | |
| C. | 用石灰石与稀盐酸制备二氧化碳:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 铜片放入浓硝酸中产生气体:3Cu+8H++2NO3-═3Cu2++2NO2↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 摩尔是国际单位制中的七个基本物理量之一 | |
| B. | 阿伏加德罗常数是0.012kg 12C中所含的原子数 | |
| C. | 摩尔质量与物质的量的多少有关,它等于物质的质量除以物质的量 | |
| D. | 阿伏加德罗常数的符号为NA,近似为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
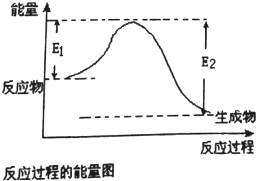 已知E1=2218kJ•mol-1、E2=2752kJ•mol-1,按要求回答问题:
已知E1=2218kJ•mol-1、E2=2752kJ•mol-1,按要求回答问题: ,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154、O-H为460,则断裂1mol N-H键所需的能量(kJ)是391kJ.
,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154、O-H为460,则断裂1mol N-H键所需的能量(kJ)是391kJ.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质的质量分数为ω=$\frac{a}{{V}_{ρ}-a}$×100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$mol•L-1 | |
| C. | 溶液中c(OH-)=$\frac{1000b}{V}$mol•L-1+c(H+) | |
| D. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com