
 阿司匹林(乙酰水杨酸,)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
阿司匹林(乙酰水杨酸,)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
分析 醋酸酐和水杨酸混合,然后向混合溶液中加入浓硫酸,摇匀后加热至85℃,然后冷却、过滤、水洗得到粗产品,然后向粗产品中加入饱和碳酸氢钠溶液,使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,从而除去杂质;然后加入浓盐酸除去剩余的碳酸氢钠、将乙酰水杨酸钠转化为乙酰水杨酸,最后过滤、洗涤、干燥得到乙酰水杨酸,
(1)乙酸酐容易发生水解,故仪器应干燥;
(2)控制温度在85℃~90℃,温度低于100℃,应采取水浴加热;
(3)①沸石可以防止液体在受热时瀑沸;
②冷凝水流向为“下进上出”,这样冷却效果好;
③由于加热时温度不能过高,应控制在一定范围之内,故使用温度计;
(4)计算理论生成乙酰水杨酸的质量,可计算出产率.
解答 解:(1)乙酸酐容易发生水解生成乙酸,故仪器应干燥防止乙酸酐水解,
故答案为:防止乙酸酐水解;
(2)控制温度在85℃~90℃,小于100℃,应使用水浴加热,
故答案为:水浴加热;
(3)①沸石可以防止液体在受热时瀑沸,
故答案为:防止暴沸;
②冷凝水流向为“下进上出”,这样冷却效果好,所以冷凝水的流出方向是c,故选c;
③由于加热时温度不能过高,应控制在一定范围之内,故使用温度计便于调控加热温度,防止乙酰水杨酸受热分解,
故答案为:便于调控加热温度,防止乙酰水杨酸受热分解;
(4)n(水杨酸)=$\frac{2.0g}{138g/mol}$=0.0145mol,n(醋酸酐)=$\frac{5.0mL×1.08g/mL}{102g/mol}$=0.053mol,则理论上生成乙酰水杨酸0.0145mol,产率为$\frac{2.2g}{0.0145mol×180g/mol}$=84.3%,
故答案为:84.3%.
点评 本题考查有机物合成的方案设计与评价,题目难度中等,本题注意把握实验操作原理,把握题给信息,掌握实验操作方法,学习中注意积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | 分子中最多有12个碳原子处于同一平面上 | |
| B. | 分子中至少有9个碳原子处于同一平面上 | |
| C. | 该烃的一氯取代物最多有4种 | |
| D. | 该烃是苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
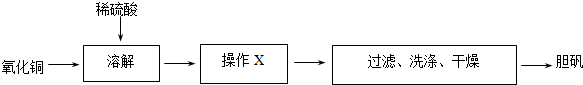
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
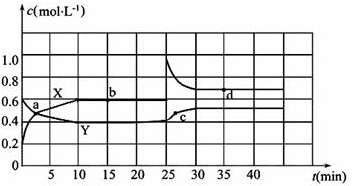
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/(g/cm3) | 溶解性 |
| 甲醇 | 64.7 | - | 0.795 | 易溶于水 |
| 乙醚 | 34.5 | - | 0.7138 | 难溶于水 |
| 3,5-二甲氧基苯酚 | 172 | 36 | - | 易溶于甲醇、乙醚、微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
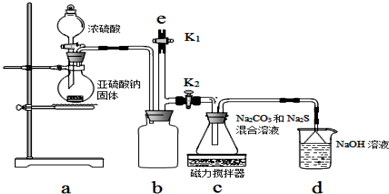
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某课外活动小组探索苯与液溴的反应是否属于取代反应,设计了如下实验装置.
某课外活动小组探索苯与液溴的反应是否属于取代反应,设计了如下实验装置.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
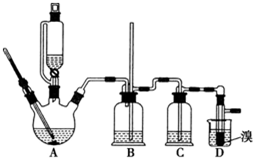 实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{1700℃}^{H_{2}SO_{4}(浓)}$CH2=CH
实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{1700℃}^{H_{2}SO_{4}(浓)}$CH2=CH| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com