

| 56 |
| 12 |
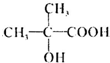 ,F为
,F为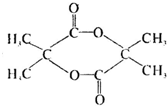 ,G比丙烯酰胺多一个CH2原子团,E发生消去反应生成G,则G为
,G比丙烯酰胺多一个CH2原子团,E发生消去反应生成G,则G为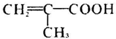 ,H为
,H为 ,H发生加聚反应可以得到K为
,H发生加聚反应可以得到K为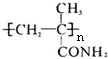 .逆推可知D为
.逆推可知D为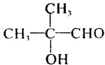 ,C为
,C为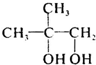 ,A为
,A为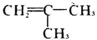 ,A转化B可以是与溴发生加成反应生成B,据此解答.
,A转化B可以是与溴发生加成反应生成B,据此解答.| 56 |
| 12 |
 ,F为
,F为 ,G比丙烯酰胺多一个CH2原子团,E发生消去反应生成G,则G为
,G比丙烯酰胺多一个CH2原子团,E发生消去反应生成G,则G为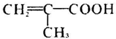 ,H为
,H为 ,H发生加聚反应可以得到K为
,H发生加聚反应可以得到K为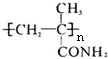 .逆推可知D为
.逆推可知D为 ,C为
,C为 ,A为
,A为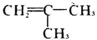 ,A转化B可以是与溴发生加成反应生成B,据此解答.
,A转化B可以是与溴发生加成反应生成B,据此解答.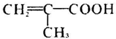 ,K的结构简式为
,K的结构简式为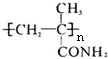 ,
,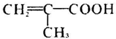 ;
;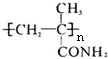 ;
; 发生消去反应生成
发生消去反应生成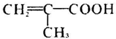 ,故答案为:加成反应;消去反应;
,故答案为:加成反应;消去反应;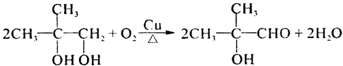 ,
,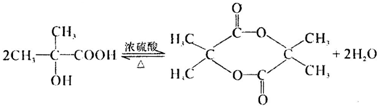 ,
, ;
; ;
; )的同种类别的同分异构体的结构简式有:CH2=CHCH2CONH2或CH3CH=CHCONH2,故答案为:CH2=CHCH2CONH2或CH3CH=CHCONH2.
)的同种类别的同分异构体的结构简式有:CH2=CHCH2CONH2或CH3CH=CHCONH2,故答案为:CH2=CHCH2CONH2或CH3CH=CHCONH2.


科目:高中化学 来源: 题型:
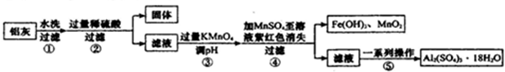
| 物质 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
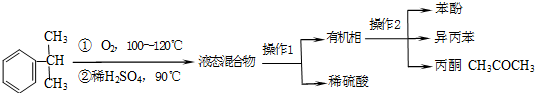
| 物质 | 沸点 | 溶解性 | 主要化学性质 |
| 异丙苯 | 152.4℃ | 不溶于水,易溶于酒精. | 可被强氧化剂氧化 |
| 苯酚 | 181.8℃ | 微溶于冷水,易溶于热水和酒精等有机溶剂. | 易被氧化 |
| 丙酮 | 56.2℃ | 易溶于水和有机溶剂 | 不易被氧化 |
| 检验项目 | 实验方案 |
| 检验丙酮中一定存在有机杂质的方法是 | A.酸性KMnO4溶液,加热 B.乙醇,溶解 C.NaOH溶液(酚酞),加热 |
| 检验丙酮中一定含有苯酚的方案是: | 取少许待测液置于试管中,滴加1~2滴FeCl3溶液.预期的实验现象和结论是 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证碳、氮、硅元素的非金属性强弱.该同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成.
某同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证碳、氮、硅元素的非金属性强弱.该同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成.查看答案和解析>>
科目:高中化学 来源: 题型:
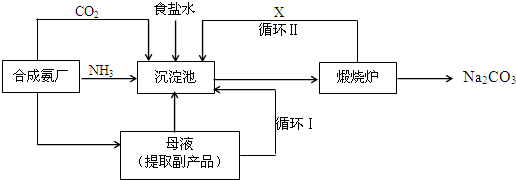
查看答案和解析>>
科目:高中化学 来源: 题型:
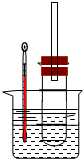 溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物.
溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com