
1)估计下列各变化过程是熵增还是熵减。
①NH4NO3爆炸:2NH4NO3(s)===2N2(g)+4H2O(g)+O2(g)
②水煤气转化:CO(g)+H2O(g)===CO2(g)+H2(g)
③臭氧的生成:3O2(g)===2O3(g)
(2)可逆反应A(g)+B(g)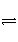
 2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如右图所示。
2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如右图所示。
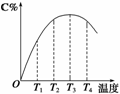
①由T1向T2变化时,正反应速率________逆反应速率。(填“>”、“<”或“=”)
②由T3向T4变化时,正反应速率________逆反应速率。(填“>”、“<”或“=”)
③反应在________温度下达到平衡。
④此反应的正反应为________热反应。
(1)①熵增 ②熵变很小 ③熵减 (2)①> ②< ③T3 ④放
解析 (1)对于有气体参与的化学反应(有气体参与反应时气体既可以是反应物也可以是产物),气体的物质的量增大的化学反应,其熵变通常是正值,即是熵增大的反应;反之,气体的物质的量减小的化学反应,其熵变通常是负值,即是熵减小的反应。若反应物中气体的物质的量与产物中气体的物质的量相等,其熵变通常都是很小的值,正负由具体的化学反应体系来决定。
NH4NO3的爆炸反应是气态物质的物质的量增大的化学反应,(2+4+1)-(0)>0,因此该过程是熵增的过程。水煤气转化反应,气态物质的物质的量反应前后未发生变化,即(1+1)-(1+1)=0,估计该过程的熵变很小。生成臭氧后,气态物质的物质的量减小,即2-3<0,因此该过程是熵减的过程。
(2)①由T1向T2变化时即温度由T1升高到T2时,C%逐渐增大,说明此时反应未达平衡,温度升高,使得反应速率加快,而且正反应的反应速率要大于逆反应的反应速率即v正>v逆。
②由T3向T4变化时,C%逐渐减小,说明在温度由T3升高到T4时,反应速率虽然提高,但是正反应的反应速率要小于逆反应的反应速率,即v正<v逆,导致C%随温度升高而减小。
③化学反应达到平衡时,正反应的反应速率等于逆反应的反应速率,即v正=v逆,由图示可知反应在T3温度下达到平衡。
④从图中可以看出,随着反应温度的继续升高,C%反而下降,可知正反应是放热反应。


科目:高中化学 来源: 题型:
臭氧具有强氧化性,可使湿润的碘化钾淀粉试纸变蓝,有关反应如下:
O3+2KI+H2O===2KOH+I2+O2 ,下列对于此反应的说法正确的是( )
A.反应中,O3是氧化剂,H2O和KI是还原剂
B.氧化产物I2与还原产物O2的物质的量之比为1∶1
C.在反应中,1 mol O3得2 mol电子
D.由此反应可知,氧化性强弱顺序为:O3>I2>O2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.其他条件不变,增大某一反应物的浓度,反应物的转化率一定都增大
B.对于有气体参加的反应,其他条件不变,增大压强,体积缩小,体系中各气体的浓度一定增大
C.对于有气体参加的反应,改变压强使平衡向右移动,生成的气体的浓度一定增大
D.增大反应物的浓度,平衡向右移动,生成物的体积分数一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气净化中的一个反应如下:
NO(g)+CO(g)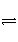

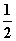 N2(g)+CO2(g)
N2(g)+CO2(g)
ΔH=-373.4 kJ·mol-1
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是( )
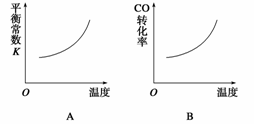
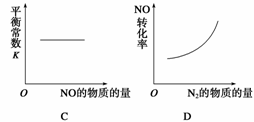
查看答案和解析>>
科目:高中化学 来源: 题型:
反应aM(g)+bN(g)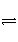
 cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如下图所示。其中z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是( )
cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如下图所示。其中z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是( )
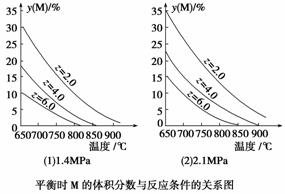
A.同温同压同z时,加入催化剂,平衡时Q的体积分数增加
B.同压同z时,升高温度,平衡时Q的体积分数增加
C.同温同z时,增加压强,平衡时Q的体积分数增加
D.同温同压时,增加z,平衡时Q的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数的值,下列说法中正确的是
A.1L 1mol·L-1的CH3COOH溶液中含有NA个氢离子
B.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol·L-1
C.0.1mol金属钠在过量氧气中充分燃烧,生成的化合物中离子总数为0.15NA
D.在VLCO和NO的混合气体中含有的氧原子个数为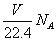
查看答案和解析>>
科目:高中化学 来源: 题型:
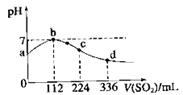
标准状况下,向100 mL H2S饱和溶液中通入SO2气体,
所得溶液pH变化如图中曲线所示。下列分析正确的是
A.原H2S溶液的物质的量浓度为0.05 mol/L
B.氢硫酸的酸性比亚硫酸的酸性强
C.b点水的电离程度比c点水的电离程度大
D.a点对应溶液的导电性比d点强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列现象或应用不能用胶体的知识解释的是( )
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.土壤表面积巨大且一般带负电,能吸收NH4+等营养离子,使土壤具有保肥能力
C.水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染
D.氯化铝溶液中加入碳酸钠溶液会出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素甲、乙、丙、丁在元素周期表的相对位置如表所示,其中甲的气态氢化物的水溶液呈碱性,则下列判断正确的是双选) )。
| 甲 | 乙 | |
| 丙 | 丁 |
A.甲位于元素周期表中第二周期ⅤA族
B.原子半径:甲>乙
C.单质的氧化性:丙>乙
D.气态氢化物的稳定性:丁>丙>乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com