
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
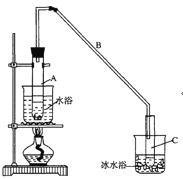
已知: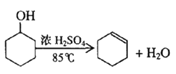

(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是___________,导管B除了导气外还具有的作用是___________。
②试管C置于冰水浴中的目的是_____________。
(2)制备精品
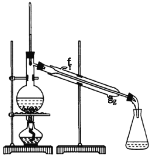
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按如图装置蒸馏,蒸馏时要加入生石灰,目的是__________________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是(_______)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
【答案】防暴沸 冷凝 防止环己烯挥发 上 c 干燥 83℃ c bc
【解析】
(1)①为了防止液体暴沸,实验时需要加入碎瓷片防止暴沸;导管B除了导气外还具有冷凝作用;
②环己烯的沸点为83℃,易挥发;
(2)①环己烯不溶于水,且密度比水小;分液后环己烯粗品中还含有少量的酸和环己醇;
②生石灰能与水反应生成氢氧化钙;
③环己烯的沸点为83℃;环己烯的精品质量偏低,说明粗产品中其他的杂质多;
(3)粗产品和精品的区别在于粗产品中含有环己醇,而精品中没有。
(1)①由方程式可知该反应为液液加热的反应,为了防止液体暴沸,实验时需要加入碎瓷片防止暴沸;由于生成的环己烯的沸点为83℃,要得到液态环己烯,导管B除了导气外还具有冷凝作用,便于环己烯冷凝,故答案为:防暴沸;冷凝;
②由于生成的环己烯的沸点为83℃,易挥发,将收集环己烯的试管置于冰水浴中,可以防止环己烯挥发,故答案为:防止环己烯挥发;
(2)①环己烯不溶于水,且密度比水小,振荡、静置、分层后环己烯在上层;由于分液后环己烯粗品中还含有少量的酸和环己醇,用Na2CO3溶液洗涤可除去酸、吸收醇;不能用酸性高锰酸钾,否则会氧化环己烯,故答案为:上;c;
②生石灰能与水反应生成氢氧化钙,除去了环己烯中残留的水起到干燥作用,蒸馏时得到纯净的环己烯,故答案为:干燥;
③环己烯的沸点为83℃,所以收集产品时,控制的温度应在83℃;环己烯的精品质量偏低,说明粗产品中其他的杂质多,所以可能是制备粗产品时环己醇一同被蒸出,故答案为:83℃;c;
(3)粗产品和精品的区别在于粗产品中含有环己醇,而精品中没有,酸性高锰酸钾溶液具有强氧化性,能氧化环己醇和环己烯,不能区分环己烯精品和粗品;钠和醇反应,与环己烯不反应。可以区分环己烯精品和粗品;环己醇的沸点和环己烯的沸点差别较大,测定沸点c也可以区分,故答案为:bc。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知25 ℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10,现向1 L 0.2 mol·L-1HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是
A. 25 ℃时,0.1 mol·L-1 HF溶液中pH=1
B. Ksp(CaF2)随温度和浓度的变化而变化
C. 该体系中没有沉淀产生
D. 该体系中HF与CaCl2反应产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Pt-g-C3N4为催化剂,用光催化氧化法脱除NO的过程如图所示。
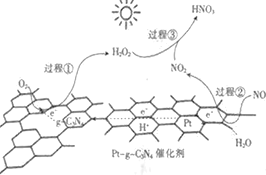
该脱除过程中,下列说法不正确的是
A. 该过程为太阳能转化为化学能
B. Pt端发生的是氧化反应
C. 过程①发生的电极反应为H2O2-2e-=O2↑+2H+
D. 过生③的化学方程式为2NO2+H2O2=2HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于反应2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。

①343 K时反应的平衡转化率α=________%。平衡常数K343 K=________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是________;要缩短反应达到平衡的时间,可采取的措施有________、________。
③比较a、b处反应速率大小:va________vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的v正/v逆=________(保留1位小数)。
(2)不同温度下水的离子积常数如表所示:
t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
Kw/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
①请用文字解释随温度升高水的离子积增大的原因_______________;
②10℃时纯水的电离平衡常数为_________;计算100℃时纯水中电离产生的氢离子浓度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和NaAlO2混合溶液中滴加NaHCO3溶液,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积的变化情况如图所示。下列说法不正确的是
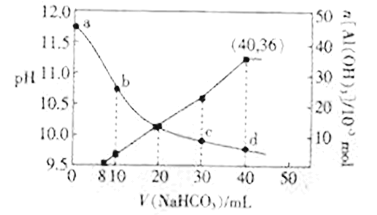
A. 加入的NaHCO3先与NaOH反应
B. b点和c点均有c(Na+)<2c(CO32-)+c(HCO3-)
C. NaHCO3溶液的物质的量浓度为1.125 mol·L-1
D. d点时:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为发光二极管连接柠檬电池装置,下列说法正确的是
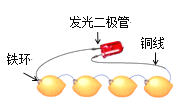
A. 铁环作为柠檬电池的正极
B. 电子由发光二极管经导线流向Fe环
C. 负极的电极反应为:Fe-2 e-===Fe2+
D. 可将柠檬替换成盛装酒精溶液的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子共存或化学用语的表述正确的是
A. 由水电离出的c(H+)=1.0×10-12 molL1的溶液中可能大量存在:Na+、K+、SO32-、HCO3-
B. 常温下,c(OH-)/c(H+)=1.0×1012的溶液中可能大量存在NH4+、Na+、Cl-、NO3-
C. 硫酸氢钠溶于水的电离方程式为:NaHSO4=Na++H++SO42-
D. 碳酸钠溶液呈碱性的原因:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO3—的摩尔电导率分别为0.60、1.98、0.45,据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
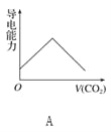
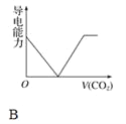

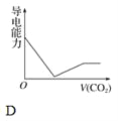
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com