
| A. | 金属铝能够在空气中稳定存在是因为其在常温下不与氧气反应 | |
| B. | 氧化铝与NaOH溶液的反应体现了氧化铝的酸性氧化物的特性 | |
| C. | 明矾的水溶液具有“净水、杀菌消毒”的作用 | |
| D. | 氢氧化铝是两性氢氧化物,其“两性”是指既具有氧化性,又具有还原性 |
分析 A、铝表面的氧化铝为致密的氧化物结构;
B、氧化铝与NaOH溶液的反应生成偏铝酸钠和水;
C、根据明矾的性质分析;
D、氢氧化铝是两性氢氧化物,其“两性”是指既具酸性,又具有碱性.
解答 解:A、铝表面的氧化铝为致密的氧化物结构,可阻止金属进一步被腐蚀,故A错误;
B、氧化铝与NaOH溶液的反应生成偏铝酸钠和水,生成盐和水,所以体现了氧化铝的酸性氧化物的特性,故B正确;
C、明矾没有强氧化性,没有消毒杀菌作用,故C错误;
D、氢氧化铝是两性氢氧化物,其“两性”是指既具酸性,又具有碱性,而不是还原性和氧化性,故D错误;
故选B.
点评 本题难度不大,物质的性质决定物质的用途,掌握常见化学物质的性质和用途是正确解答此类题的关键.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:选择题
| A. | 工业生产硫酸时,常用NaOH吸收尾气中的少量SO2 | |
| B. | 利用Fe3+作为混凝剂,可以对硬水进行软化 | |
| C. | N2与O2作用生成NO,属于氮的固定 | |
| D. | 石油的分馏、煤的气化或液化都是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 装置 | 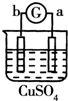 | 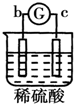 | 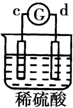 | 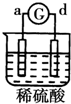 |
| 部分实验现象 | a极质量减小b极质量增加 | 溶液中的SO42-向b极移动 | d极溶解c极有气体产生 | 电子从d极流向 a极 |
| A. | d>a>b>c | B. | a>b>c>d | C. | b>c>d>a | D. | a>b>d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过煤的干馏可以获得焦炭 | |
| B. | 煤中含有苯和甲苯,可以用蒸馏的方法把它们分离出来 | |
| C. | 石油裂解的目的是为了得到乙烯、丙烯和1,3-丁二烯等短链不饱和烃 | |
| D. | 煤液化后可以得到甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①②④ | C. | ①② | D. | 只有② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着反应的进行,容器内压强始终不变 | |
| B. | 及时地分离出N2或CO2,正反应速率加快 | |
| C. | 升高温度(其它条件不变),可提高反应物的转化率 | |
| D. | 使用不同催化剂(其它条件不变),该反应的平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、Na+ | |
| B. | 水电离出的c(H+)=10-12mol•L-1的溶液中:Ca2+、K+、Cl-、HCO${\;}_{3}^{-}$ | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的水溶液中:NH${\;}_{4}^{+}$、Al3+、NO${\;}_{3}^{-}$、Cl- | |
| D. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO${\;}_{4}^{2-}$、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 )与新制氢氧化铜反应的化学方程式C6H5CHO+NaOH+2Cu(OH)2$\stackrel{水浴}{→}$C6H5COONa+Cu2O↓+3H2O
)与新制氢氧化铜反应的化学方程式C6H5CHO+NaOH+2Cu(OH)2$\stackrel{水浴}{→}$C6H5COONa+Cu2O↓+3H2O查看答案和解析>>
科目:高中化学 来源: 题型:填空题
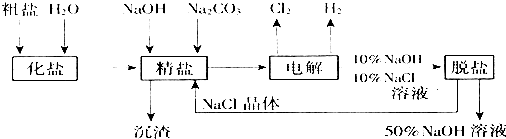
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com