
 �״�����Ϊ21���͵�����ȼ�ϣ���ҵ����CH4��H2OΪԭ��ͨ�����з�Ӧ�ٺ͢ڣ�
�״�����Ϊ21���͵�����ȼ�ϣ���ҵ����CH4��H2OΪԭ��ͨ�����з�Ӧ�ٺ͢ڣ�| ʵ���� | T����C�� | n��CO��/n��H2�� | p��MPa�� |
| �� | 150 | 1/3 | 0.1 |
| �� | 5 | ||
| �� | 350 | 5 |
���� ��1���¶Ȳ��䣬��С�������ѹǿ����Ӧ��������
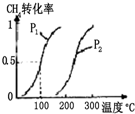
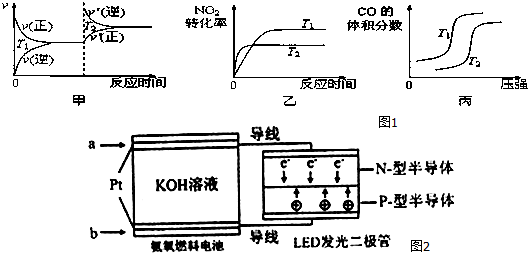
��2����ȡ���Ʊ�������������ͼ��֪ѹǿ��ͬʱ������ƽ��ʱ���¶�Խ��CH4��ת����Խ�������¶�ƽ��������Ӧ�ƶ�����100��ƽ��CH4��ת����Ϊ0.5��֪������CH40.01mol������CH4��Ũ�ȱ仯�����ٸ���v=$\frac{��c}{��t}$����v��CH4������������ʽ����ƽ��ʱ����ֵ�ƽ��Ũ�ȣ�����ƽ�ⳣ������ʽ���㣻���������ݻ�ѹ����ԭ����$\frac{1}{2}$��ѹǿ����Ӧ��������ƽ��������Ӧ�����ƶ����Դ��жϣ�
��3����ͬѧͨ�������Ʊ�������̽����������Ի�ѧƽ���Ӱ�죬̽����ǰ��ֻ���Ǹı�һ���������������������䣬�ݴ˽��
��4����2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��g����H=-1275.6kJ•mol-1
��2CO��g��+O2��g���T2CO2��g����H=-566.0kJ•mol-1
��H2O��g���TH2O��l����H=-44.0kJ•mol-1���ݸ�˹���ɣ�����֪��Ӧ$\frac{1}{2}$������-��+�ۡ�4���õ�CH3OH��l��+O2��g��=CO��g��+2H2O��l�����ݴ˼���÷�Ӧ�ġ�H��
��5���ŵ�ʱ���൱��ԭ��صĹ���ԭ�������������õ��ӵĻ�ԭ��Ӧ����������ʧ���ӵ�������Ӧ��
��� �⣺��1���¶Ȳ��䣬��С�������ѹǿ����Ӧ�������ʴ�Ϊ������
��2����ȡ���Ʊ�������������ͼ��֪ѹǿ��ͬʱ������ƽ��ʱ���¶�Խ��CH4��ת����Խ�������¶�ƽ��������Ӧ�ƶ���������ӦΪ���ȷ�Ӧ������H��0��
��100��ƽ��CH4��ת����Ϊ0.5��֪������CH4Ϊ0.2mol��0.5=0.1mol��ƽ��ʱ�����Ũ�ȱ仯��Ϊ0.01mol/L����v��CH4��=0.005mol/��L•min����
ƽ��ʱ�����Ũ�ȱ仯��Ϊ0.01mol/L����
CH4��g��+H2O��g��?CO��g��+3H2��g��
��ʼ��mol/L����0.02 0.03 0 0
�仯��mol/L����0.01 0.01 0.01 0.03
ƽ�⣨mol/L����0.01 0.02 0.01 0.03
��100��ʱƽ�ⳣ��k=$\frac{0.0{3}^{3}��0.01}{0.02��0.01}$=1.35��10-3��
�ʴ�Ϊ������1.35��10-3��
��3��ͨ�������Ʊ�������̽����������Ի�ѧƽ���Ӱ�죬̽����ǰ��ֻ���Ǹı�һ���������������������䣬�ɴ˿ɵã������¶�Ϊ150�棬n ��CO��/n��H2��Ϊ$\frac{1}{3}$������n ��CO��/n��H2��Ϊ$\frac{1}{3}$�����������ݻ�ѹ����ԭ����$\frac{1}{2}$��ѹǿ���������淴Ӧ���ʶ�����ƽ��������Ӧ�����ƶ���CH3OH�����ʵ������ӣ�Ũ���������������ʵ������٣���Ũ�����״������ʵ������࣬Ũ��������c��H2��/c��CH2OH��=n��H2��/n��CH3OH����С����ѡCD��
�ʴ�Ϊ��
| ʵ���� | T���棩 | n ��CO��/n��H2�� | P��MPa�� |
| I | |||
| II | 150 | $\frac{1}{3}$ | |
| III | $\frac{1}{3}$ |
���� ���⿼�黯ѧƽ��ͼ��Ӧ���ʼ��㡢��ѧƽ�ⳣ�����йؼ��㡢��ѧƽ���Ӱ�����ء����ε�ص��й�֪ʶ�ȣ��Ѷ��еȣ���3����ע��ͨ�������Ʊ�������̽����������Ի�ѧƽ���Ӱ�죮


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
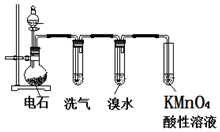 ��ͼΪʵ������ȡ��Ȳ����֤�����ʵ�װ��ͼ���ش��������⣺
��ͼΪʵ������ȡ��Ȳ����֤�����ʵ�װ��ͼ���ش��������⣺ ��ʵ���ҿ�ͨ�����м����Ӳ�Ҷ����ȡ������
��ʵ���ҿ�ͨ�����м����Ӳ�Ҷ����ȡ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | MnO4��Mn2- | B�� | HCl��Cl2 | C�� | Fe��Fe3- | D�� | KClO3��O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ѧ��Ӧ���ʣ�4v����O2��=5v����NO�� | |
| B�� | NH3��O2��NO��H2O�ķ��Ӹ�������4��5��4��6 | |
| C�� | ��λʱ��������4 mol NO��ͬʱ����6 mol H2O | |
| D�� | ��Ӧ�������NH3������������ٸı� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ڢۢ� | C�� | �٢� | D�� | �٢ڢۢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ʱ��/min Ũ��/��mol/L�� | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��NaCl��Ϊԭ���Ʊ�KClO4�Ĺ������£�
��NaCl��Ϊԭ���Ʊ�KClO4�Ĺ������£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �������״������ʵ����ȼ�ϣ�������ȼ�ϵ�أ�
�������״������ʵ����ȼ�ϣ�������ȼ�ϵ�أ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
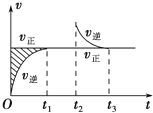 �����ܱ������������淴Ӧ��Z������+W������?X��g��+Y����������H����t1ʱ�̷�Ӧ�ﵽƽ�⣬��t2ʱ����С���������t3ʱ���ٴδﵽƽ��״̬��δ�ٸı������������й�˵������ȷ���ǣ�������
�����ܱ������������淴Ӧ��Z������+W������?X��g��+Y����������H����t1ʱ�̷�Ӧ�ﵽƽ�⣬��t2ʱ����С���������t3ʱ���ٴδﵽƽ��״̬��δ�ٸı������������й�˵������ȷ���ǣ�������| A�� | Z��W�ڸ���������һ����Ϊ��̬ | |
| B�� | t1��t2ʱ�����t3ʱ�̺���ʱ��η�Ӧ��ϵ�������ƽ��Ħ��������������� | |
| C�� | ���ڸ��¶��´˷�Ӧƽ�ⳣ������ʽΪK=c��X������t1��t2ʱ�����t3ʱ�̺��XŨ�Ȳ���� | |
| D�� | ���÷�Ӧֻ��ij�¶�T0�����Է����У���÷�Ӧ��ƽ�ⳣ��K���¶����߶����� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com