
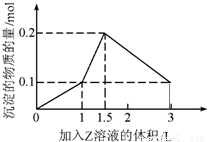


科目:高中化学 来源: 题型:
| m |
| M |
| m |
| M |
| 2mNA |
| M |
| 2mNA |
| M |
| 22.4m |
| M |
| 22.4m |
| M |
| m |
| (m+1000) |
| m |
| (m+1000) |
| 18V |
| 11.2 |
| 18V |
| 11.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.00 | 31.00 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- |
K1=4.31×10-7 K2=5.61×10-11 |
|
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
|
| NH3?H2O | NH3?H2O?NH4++OH- | 1.76×10-5 | |
| BaSO4 | BaSO4?Ba2++SO42- | 1.07×10-10 | |
| BaCO3 | BaCO3?Ba2++CO32- | 2.58×10-9 |
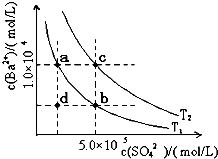
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)
(1)下列事实中,能证明亚硫酸的酸性强于氢硫酸的是 (填字母)。
a.亚硫酸受热时易分解
b.相同条件下,等浓度的亚硫酸溶液导电能力强于氢硫酸
c.亚硫酸溶液可使品红溶液褪色,而氢硫酸不能
d.常温下,浓度均为0.1mol/L的H2SO3溶液和H2S溶液的pH分别是2.1和4.5
(2)工业上除去高压锅用水中溶解的氧气常用的试剂有Na2SO3和N2H4(肼)。
①已知16g液态的肼与氧气反应得到氮气和液态水时,放热354.87kJ,该反应的热化学方程式是 。
②除去等质量的O2,所耗Na2SO3和N2H4的质量比是 (填最简整数比)。
(3)向Na2SO3和Na2S的混合溶液中加入稀盐酸,溶液中会产生大量淡黄色沉淀。则该反应中氧化剂和还原剂的物质的量之比是 。
(4)已知Na2SO3在高温下发生分解,得到两种产物。某同学称取25.2g纯净的Na2SO3·7H2O晶体在高温下隔绝空气加热至恒重,冷却后称得固体为12.6g,将其完全溶于水配成1L溶液,并测溶液的pH。
①Na2SO3高温分解的化学方程式是 。
②测得溶液的pH大于0.025mol/LNa2SO3溶液的pH,试解释原因(结合离子方程式说明) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com