
| A. | 泥水 | B. | 蒸馏水 | C. | 硫酸铜溶液 | D. | 氢氧化铁胶体 |
分析 溶液与胶体、浊液的粒径不同,溶液中分散质粒径一般小于1 nm,胶体中分散质粒径一般为1~100 nm;浊液的分散质粒径大于100 nm,溶液和胶体都是透明的澄清溶液,可以通过丁达尔现象来区分,胶体用激光笔照射,能在与光束垂直的方向上观察到光亮的通路.
解答 解:A.泥水为浊液,无丁达尔现象,故A错误;
B.蒸馏水为纯净物,不属于分散系,无无丁达尔现象,故B错误;
C.硫酸铜溶液属于溶液,无丁达尔现象,故C错误;
D.氢氧化铁胶体,用激光笔照射,能在与光束垂直的方向上观察到光亮的通路,故D正确;
故选D.
点评 本题主要考查了胶体的鉴别,注意溶液和胶体都是透明的澄清溶液,可以通过丁达尔现象来区分,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥ | B. | ②③④⑤ | C. | ①②③④⑥ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (C6H10O5)n可表示麦芽糖或淀粉 | |
| B. | 反应②的产物除了乙醇还有一种直线型分子 | |
| C. | 反应①③属于加成反应且所用的催化剂相同 | |
| D. | 乙酸乙酯的同分异构体(不含本身)中能与NaOH溶液反应的有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
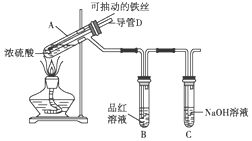 合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.
合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
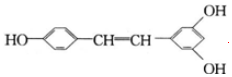 )广泛存在于食物(例如桑葚、花生、尤其是葡萄)中,它可能具有抗癌性,能够跟1mol该化合物起反应的Br2和H2的最大用量分别是6mol、7mol.
)广泛存在于食物(例如桑葚、花生、尤其是葡萄)中,它可能具有抗癌性,能够跟1mol该化合物起反应的Br2和H2的最大用量分别是6mol、7mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
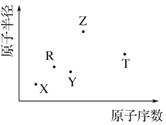 短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )
短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 最高价氧化物对应水化物的酸性:T<R | |
| C. | 氢化物的沸点不一定是:Y>R | |
| D. | 由 X、R、Y、Z 四种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
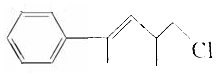 的下列叙述中不正确的是( )
的下列叙述中不正确的是( )| A. | 分子式是C12H15Cl,属于卤代烃 | |
| B. | 1mol该物质最多能与4molH2发生加成反应 | |
| C. | 既能使溴水褪色,又能使KMnO4 酸性溶液褪色 | |
| D. | 该溶液与酸化的AgNO3 溶液混合时会产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3-,K+,[Al(OH)4]-,OH- | B. | Na+,Ba2+,Mg2+,HCO3- | ||
| C. | NO3-,Mg2+,K+,Cl- | D. | NH4+,NO3-,CO32-,Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com