
【题目】铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3大量地用于电镀工业中. 
(1)在如图装置中,观察到图 1 装置铜电极上产生大量的无色气泡,而图 2 装置中铜电 极上无气体产生,铬电极上产生大量有色气体.
图 2 装置中铬电极的电极反应式
(2)最近赣州酒驾检查特别严,利用 CrO3 具有强氧化性,有机物(如酒精)遇到 CrO3 时,猛烈反应,CrO3 被还原成绿色的硫酸铬[Cr2(SO4)3],另该过程中乙醇被氧化成乙酸,从而增强导电性,根据电流大小可自动换算出酒精含量.写出该反应的化学方程式为 .
(3)虽然铬加到铁中可将铁做成不锈钢可减少金属腐蚀,但 生产成本高,生活中很多情况下还是直接使用钢铁,但易腐蚀,利用右图装置 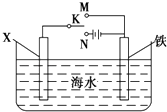 ,可以模拟铁的电化学防护.若 X 为碳棒,为减缓铁的腐蚀,开关 K 应置于处.若 X 为锌,开关K 置于处.
,可以模拟铁的电化学防护.若 X 为碳棒,为减缓铁的腐蚀,开关 K 应置于处.若 X 为锌,开关K 置于处.
(4)CrO3 和 K2Cr2O7 均易溶于水,这是工业上造成铬污染的主要原因.净化处理方法之一是将含+6 价 Cr 的废水放入电解槽内,用铁作阳极,加入适量的 NaCl 进行电解:阳极区生成的 Fe2+和 Cr2O72﹣发生反应,生成的 Fe3+和 Cr3+在阴极 区与OH﹣结合生成 Fe(OH)3和 Cr(OH)3 沉淀除去,已知某条件下的KspFe(OH)3=3.0×10﹣31 , KspCr(OH)3=6.0×10﹣38 . 已知电解后的溶液中 c(Fe3+)为 2.0×10﹣6 molL1 , 则溶液中 c(Cr3+)=molL﹣1 .
【答案】
(1)NO3﹣+4H++3e﹣=NO↑+2H2O
(2)4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O
(3)N;N或M
(4)4.0×10﹣13
【解析】解:(1)图1装置铜电极上产生大量的无色气泡,说明Cr的活泼性大于Cu,而图 2装置中铜电极上无气体产生,铬电极上产生大量有色气体,说明Cr为正极、Cu为负极,则Cr和硝酸能产生钝化现象,正极上硝酸根离子得电子发生还原反应生成NO,电极反应式为:NO3﹣+4H++3e﹣=NO↑+2H2O,
所以答案是:NO3﹣+4H++3e﹣=NO↑+2H2O;
(2.)由题目信息可知,CrO3、C2H5OH、H2SO4反应生Cr2(SO4)3、CH3COOH,同时还有水生成,反应方程式为:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O,
所以答案是:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O;
(3.)若 X 为碳棒,开关 K 应置于M处,构成原电池,Fe为负极,加速Fe的腐蚀,开关 K 应置于N处,构成原电池,Fe为阴极,被保护,减缓铁的腐蚀,
若 X 为锌,开关 K 应置于M处,构成原电池,Zn为负极,Fe被保护,减缓铁的腐蚀,开关 K 应置于N处,构成原电池,Fe为阴极,被保护,减缓铁的腐蚀,
所以答案是:N;N或M;(4)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH﹣)=2.0×10﹣6×c3(OH﹣)=3.0×10﹣31 ,
Ksp[Cr(OH)3]=c(Cr3+)×c3(OH﹣)=6.0×10﹣38
联立可得c(Cr3+)=4.0×10﹣13mol/L,
所以答案是:4.0×10﹣13 .


科目:高中化学 来源: 题型:
【题目】常温下,0.1mol/L CH3COONa溶液pH=9,则下列说法正确的是( )
A.加入少量NaOH固体后溶液pH小于9
B.加水稀释,CH3COONa水解程度增大,c(OH﹣)增大
C.该溶液水电离出的c(OH﹣)═10﹣9
D.CH3COOH在常温下Ka数值约为1×10﹣5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
a、2NO(g)+Cl2(g)2ClNO(g)△H1<0 其平衡常数为K1
b、2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)△H2<0 其平衡常数为K2
(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)△H3的平衡常数K=(用K1、K2表示).△H3=(用△H1、△H2表示).
(2)为研究不同条件对反应a的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2 , 10min时反应a达到平衡.测得10min内V(ClNO)=7.5×10﹣3molL﹣1min﹣1 , 则平衡后n(Cl2)=mol,NO的转化率α1= . 其它条件保持不变,反应(1)在恒压条件下进行,平衡时NO的转化率为α2 , α1α2(填“>”“<”或“=”),平衡常数K1(填“增大”“减小”或“不变”).若要使K1减小,可采用的措施是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为 2CH3OH+3O2+4KOH═2K2CO3+6H2O.下列说法正确的 是( ) 
A.若将乙池电解液换成 AgNO3 溶液,则可以实现在石墨棒上镀银
B.甲池通入 CH3OH 的电极反应式为 CH3OH+6e﹣+2H2O═CO32﹣+8H+
C.反应一段时间后,向乙池中加入一定量 Cu(OH)2 固体,能使 CuSO4溶液恢复到 原浓度
D.甲池中消耗 224mL(标准状况下)O2 , 此时丙池中理论上产生 1.16g 固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料 的电池装置如图所示,该电池以空气中的氧气为氧化剂,以 KOH 溶液为电解质溶液.下列 关于该电池的叙述错误的是( ) 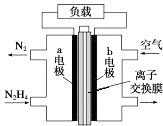
A.b 极发生还原反应
B.a 极的反应式为 N2H4﹣4e﹣═N2↑+4H+
C.放电时,电流从 b 极经过负载流向 a 极
D.其中的离子交换膜需选用阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积可变的密闭容器中发生反应:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)。
Fe3O4(s)+4H2(g)。
回答下列问题:
(1)增加Fe的量,正反应速率 (填“增大”、“减小”或“不变”,下同)。
(2)将容器的容积缩小一半,正反应速率 ,逆反应速率 。
(3)保持容器的容积不变,充入N2使体系压强增大,正反应速率 ,逆反应速率 。
(4)保持压强不变,充入N2使容器的容积增大,正反应速率 ,逆反应速率 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1molL﹣1、体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg ![]() 随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )
随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( ) 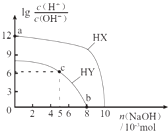
A.HX的酸性弱于HY
B.a点由水电离出的c(H+)=10﹣12 molL﹣1
C.c点溶液中:c(Y﹣)>c(HY)
D.b点时酸碱恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碳及其化合物的叙述中错误的是
A.12C、13C、14C互为同位素
B.金刚石和石墨互为同素异形体
C.石墨转化为金刚石属于化学变化
D.向空气中排放二氧化碳会形成酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于蒸馏操作的说法不正确的是
A. 烧瓶内放碎瓷片的目的是防止暴沸
B. 烧瓶不能直接加热,应垫上石棉网
C. 实验时发现烧瓶中没有放碎瓷片,应停止加热,马上加入
D. 在点燃酒精灯加热前,应先通冷却水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com