
【题目】短周期元素W、X 、Y 和Z 在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1) X在元素周期表中的位置为_______;画出X的简单离子结构示意图_______。
已知X元素的一种原子,其中子数为10,写出这种原子的原子符号_____________。
(2)四种元素简单离子的半径由大到小为_____________(用离子符号表达)。
(3)W、X的最简单氢化物稳定性为_______>________(填化学式)。
(4)Z最高价氧化物的水化物与Y最高价氧化物对应水化物反应的化学方程式为______ 。
(5)ZX2气体是一种广谱杀菌消毒剂。工业上可利用NaZX3和NaZ 在酸性条件下制得ZX2 同时得到Z元素的单质,该反应的离子方程式为_____________。
【答案】第2周期 ⅥA族 ![]()
![]() Cl->N3->O2->Al3+ H2O NH3 Al(OH)3+3HClO4=Al(ClO4)3+3H2O 2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O
Cl->N3->O2->Al3+ H2O NH3 Al(OH)3+3HClO4=Al(ClO4)3+3H2O 2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O
【解析】
由元素在周期表中的位置可知,W、X为第二周期,Y、Z为第三周期,设Y的最外层电子数为n,则W的最外层电子数为n+2、X的最外层电子数为n+3、Z的最外层电子数为n+4,则n+(n+2)+(n+3)+(n+4)=21,解得:n=3,则Y为Al元素,W为N元素,X为O元素,Z为Cl元素,结合对应元素及其化合物的性质以及元素周期律分析解答。
根据上述分析,Y为Al元素,W为N元素,X为O元素,Z为Cl元素。
(1)X为O元素,原子序数为8,位于元素周期表中第二周期ⅥA族,O2-的结构示意图为![]() ;O的质子数=8,中子数=10,则质量数=8+10=18,原子符号为
;O的质子数=8,中子数=10,则质量数=8+10=18,原子符号为![]() ,故答案为:第二周期ⅥA族;
,故答案为:第二周期ⅥA族;![]() ;
;![]() ;
;
(2)离子的电子层越多,离子半径越大,电子层数相同时,核电荷数越大,离子半径越小,则四种元素简单离子的半径由大到小为:Cl->N3->O2->Al3+,故答案为:Cl->N3->O2->Al3+;
(3) W为N元素,X为O元素,非金属性越强,简单氢化物越稳定,非金属性O>N,则氢化物稳定性H2O>NH3,故答案为:H2O;NH3;
(4) Z为Cl元素,Y为Al元素。Z最高价氧化物的水化物为高氯酸,Y最高价氧化物对应水化物为氢氧化铝,二者反应的化学方程式为Al(OH)3+3HClO4=Al(ClO4)3+3H2O,故答案为:Al(OH)3+3HClO4=Al(ClO4)3+3H2O;
(5)ClO2气体是一种广谱杀菌消毒剂,工业上可利用NaClO3和NaCl在酸性条件下制得ClO2同时得到Cl2,该反应的离子方程式为:2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O,故答案为:2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C是原子序数依次增大的短周期主族元素,三种元素原子序数之和为35,且C的原子序数是A的2倍。A、B、C三种元素的单质在适当条件下可发生如图所示的变化。下列说法不正确的是

A. 甲、乙、丙三种物质的水溶液均显碱性
B. 原子半径:r(A)<r(C)<r(B)
C. 甲、乙可能都具有漂白性
D. 丙的水溶液在空气中长期放置,溶液可能会变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由核电荷数1~18的某些元素组成的单质 A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示的转换关系,A是地壳中含量最多的金属元素。 请回答下列问题:
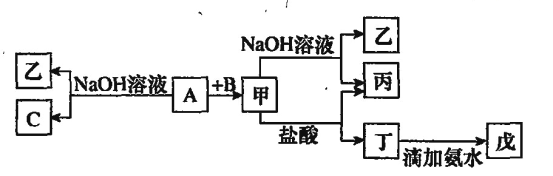
(1)写出下列物质的化学式:乙__________、丁__________、戊__________.
(2)写出甲物质在工业上的一种主要用途:__________。
(3)写出甲→乙+丙反应的离子方程式:__________。
(4)A→乙+C反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质可以实现一步转化的是( )
A. N2→NO2→HNO3→NH4ClB. Al→Al2O3→Al(OH)3→AlCl3
C. Cu→CuCl2→Cu(OH)2→CuOD. Si→SiO2→H2SiO3→NaSiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CeO2通常既不溶于强酸,也不溶于强碱。某工厂以平板电视显示屏厂的废玻璃粉末(含CeO2、SiO2、Fe2O3、FeO等物质)为原料,设计如下图所示工艺流程,制得纯净的CeO2。下列说法正确的是( )
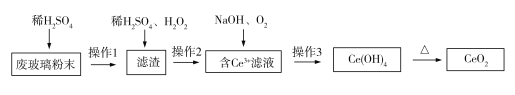
A. 实验室中,操作3和操作1、操作2所用仪器不同
B. 滤渣中加入稀H2SO4和H2O2,其中H2O2做氧化剂
C. 滤液中Ce3+与NaOH、O2的反应属于化合反应
D. 操作2分离得到的滤渣中一定含有未反应的SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学平衡常数K的说法中,正确的是
A. K的大小与起始浓度有关
B. 温度越高,K值越大
C. K值越大,反应正向进行的程度越大
D. K值越大,反应正向进行的程度越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式________________。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与2 mol·L-1NaOH溶液等体积混合而成,则溶液M的pH________7(填“<”、“>”或“=”),溶液中离子浓度由大到小顺序为________________。已知常温下Ksp(BaA)=1.8×10-10,向该混合溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为__________ mol·L-1。
(3)若溶液M有下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为_________________。
(4)若溶液M由pH=3的H2A溶液V1mL与pH=11的NaOH溶液V2mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为_________(填“大于”“小于”“等于”或“均有可能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国具有独立知识产权的电脑芯片“龙芯一号”的问世,填补了我国计算机制造史上的一项空白。下列对晶体硅的有关叙述正确的是
A.晶体硅的结构与金刚石类似
B.晶体硅的化学性质不活泼,常温下不与任何物质发生反应
C.晶体硅是一种良好的半导体材料,但是它提炼工艺复杂,价格昂贵
D.晶体硅具有金属光泽,故它属于金属材料,可以导电
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com